Способ перемешивания икры рыб в процессе ее инкубации в аппаратах "вейса". Инкубация икры в аппаратах вейса
ИНКУБАЦИЯ ИКРЫ
Количество просмотров публикации ИНКУБАЦИЯ ИКРЫ - 311
Рис. 26. Получение и оплодотворение икры толстолобика, выращенного в водоеме-охладителе ЗайГРЭС.
При индустриальных методах разведения рыб инкубация икры происходит в специальных аппаратах, сконструированных таким образом, чтобы создать благоприятные условия для развития эмбрионов.
Существует много систем инкубационных аппаратов, которые можно объединить в две группы, соответствующие двум технологическим схемам. В первом случае икра обесклеивается с помощью обесклеивающих препаратов и инкубируется во взвешенном состоянии в аппаратах Вейса, ВНИИПРХа, Чеза, Цугера. Во втором случае икра инкубируется, на субстратах в прикрепленном состоянии (инкубационные аппараты Жуковского, Коста, Вильямсона, Орава, Шустера, Садова-Коханской и др.).
Аппарат Вейса представляет собой стеклянный или из органического стекла сосуд суживающийся книзу (рис.31).
Рис.31. Аппарат Вейса для инкубации икры карпа˸
а — инкубационный сосуд; б — пробка; в — медная трубка;
г — шланг водоподачи
Нижнее отверстие аппарата закрыто пробкой со вставленной по центру металлической трубкой диаметром 0,8-1,0 см. Наружный конец этой трубки соединен со шлангом, который надет на кран, подающий воду (рис.3).
Токи воды, идущие из крана, поступают под напором в нижнюю часть сосуда и поднимают вверх помещенную в аппарат икру. В верхней части сосуда напор воды ослабевает, поэтому икринки начинают постепенно опускаться в нижнюю ᴇᴦο часть, где подхватываются струями вода и вновь увлекаются вверх. Таким образом, вся икра находится во взвешенном состоянии. Сброс воды из аппарата происходит через сливной носик. сделанный в обруче, обтягивающем верхний край сосуда.
Емкость аппарата Вейса составляет 7-20 литров. Норма загрузки икры составляем 35-110 тыс.шт.Расход воды – до 6 л/мин, а перед вылуплением проточность увеличивают до 10 л/мин.
Обычно аппараты размещают на стойках в специально подготовленные гнезда. Их монтируют по 10-20 штук на одной стойке, причем для каждого из них обязательно независимое водоснабжение.
Аппараты конструкции ВНИИПРХа емкостью от 50 до 200 л используются для инкубации эмбрионов карпа и растительноядных рыб. В каждый аппарат закладывают в среднем 500 тыс. оплодотворенных икринок (примерно 500 г). Перед загрузкой в аппарате устанавливают слабую проточность воды (0,5 л/мин), а после закладки икры поступление воды в аппарат увеличивают до 4-8 л/мин.
По аналогичному принципу работают инкубационные аппараты Чеза и Цугера. Планируемый выход личинок составляет 50%, в то время как в аппаратах Вейса – 60-80%. Значительный отход икры в аппаратах большой емкости связан с тем, что икра плохо перемешивается, образуются застойные зоны, а при частом перемешивании происходит травматизация икры. Тем не менее на юге страны практикуется инкубация икры в аппаратах ВНИИПРХ, поскольку в них после карпа проводится инкубация икры растительноядных рыб, что удобно и экономично для хозяйств.
Аппарат Б.И. Казанского предназначен для инкубирования икры осетровых рыб. Он состоит из стеклянного баллона, водосбросного кольца с водосливом в верхней части баллона, водоструйной головки, сетчатого стаканчика-вкладыша. Струи воды поднимаются вверх и перемешивают икру. Емкость аппарата – 1,25 кг икры (2,5 л).
referatwork.ru
Влияние механического воздействия на икру нельмы на ранних этапах эмбрионального развития (использование разных методов инкубации икры)
Просмотров: 99
Влияние механического воздействия на икру нельмы на ранних этапах эмбрионального развития (использование разных методов инкубации икры)
Как известно, икра сиговых рыб на ранних этапах развития довольно чувствительна к механическому воздействию. В первые сутки жизни зародыша это связано с еще неокрепшими покровами икринки, вследствие чего даже небольшой механический контакт с икрой способен нанести вред как внешней, так и внутренней оболочке (Зотин, 1961; Кугаевская, 1981, 1985; Черняев и др., 1987; Смешливая, Семенченко, 2013, 2015). Однако даже после завершения процесса набухания (оводнения) икра сохраняет восприимчивость к раздражениям механической природы. Н.Д. Никифоровым (1939) было определено, что пятиминутное сотрясение икры волховского сига на стадии морулы средних клеток приводит к гибели в среднем 15,7% икринок, в начале гаструляции – 78%, стадии формирования осевых органов – до 100% (возраст эмбрионов 18 сут., около 52 градусо-дней).
В рыбоводной практике для инкубации икры сиговых рыб традиционно применяются аппараты Вейса (его описание приведено ниже), однако выживаемость икры в них, особенно на ранних этапах эмбрионального развития, не всегда бывает удовлетворительной. Более того, сиговая икра в первое время после оплодотворения обладает высокой клейкостью даже после обработки, например, танином. В этот период в аппаратах устанавливается повышенный водообмен для упреждения комкования икры и образования застойных зон, что приводит к активной циркуляции икры, и, как следствие, к увеличению смертности эмбрионов.
С целью повышения выживаемости икры нельмы в процессе инкубации нами был опробован принципиально новый метод с применением аппаратов, предназначенных для инкубации икры форели (опыт 2012 г.) (Лютиков, Костюничев, 2013), а также модифицированные нами аппараты Вейса (опыт 2015 г).
Аппараты форелевого типа представляют собой 20-литровые емкости цилиндрической формы, в которых икра размещается на решетке, расположенной в 5-7 см от дна (рис. 9). Вода подается через шланг в нижнюю часть аппарата, равномерно распределяется по всему объему и вытекает через отверстие в его верхней части.
Закладку икры в опытные аппараты проводили спустя 10-15 мин с момента осеменения, ее объем составлял 4 л/аппарат (после набухания объем икры в аппарате увеличивался до 10 л), проточность воды ? 4 л/мин. В эксперименте было задействовано по 8 аппаратов форелевого типа и обычных восьмилитровых аппаратов Вейса, которые использовались в качестве контроля. Икру в контрольные аппараты закладывали в возрасте около 1 сут., проточность них составляла 3 л/мин. Наблюдение за развитием икры вели на живом материале.
Модифицированный аппарат Вейса представляет собой стандартный одноименный аппарат, в конусе которого устанавливается и фиксируется круглая решетка, на которой размещается икра (рис. 10). Аппарат Вейса – это стеклянный 8-литровый сосуд, нижняя треть которого сужается в виде конуса. В нижнюю горловину устанавливается штуцер, через который подается вода. В верхней части аппарата устанавливается пластиковый водосливной желоб, через который осуществляется выток воды.

Помещение икры на инкубацию осуществлялось через 16-18 ч после осеменения, ее объем в каждом аппарате составлял 4,5 л, проточность – 2,5 л/мин. Эксперимент по исследованию возможности инкубации икры нельмы в модифицированных аппаратах Вейса состоял из двух серий опытов. В первой серии было задействовано по 6 опытных и контрольных аппаратов (опыт 1), во второй серии по 4 (опыт 2). В качестве контроля, как и в опыте 2012 г. были использованы классические аппараты Вейса.
Принцип работы опытных аппаратов заключается в ослаблении влияния тока воды на икру и предотвращении ее интенсивной циркуляции. Эффективность использования форелевых аппаратов для инкубации икры нельмы была отмечена спустя 7 суток (31,6 градусо-дней) с момента оплодотворения, выживаемость зародышей в экспериментальных аппаратах в среднем равнялась 92%, в аппаратах Вейса ? 86%. Икра к этому времени находилась на этапе обрастания желтка клеточным материалом.
В возрасте 11 суток (47,2 градусо-дней) к началу формирования эмбриона выживаемость икры в опыте составляла 87%, в контроле 78%. Помимо относительно высокого процента гибели икры в аппаратах Вейса, ее развитие сопровождалось асинхронностью, то есть не единовременным прохождением отдельных этапов эмбриогенеза (рис. 11).
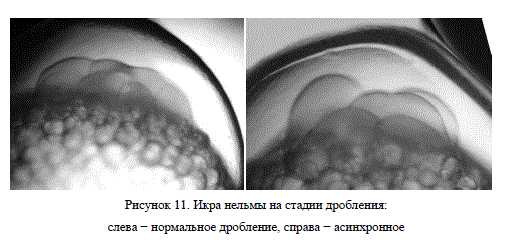
Причиной этому, как отмечалось выше, может быть высокая чувствительность икры к механическим воздействиям (сильный ток воды), а также нестабильное положение икринок в процессе инкубации, которое, по мнению некоторых авторов (Дорфман, Черданцев, 1977), способно нарушать нормальный ход развития эмбриона. Таким образом, использование аппаратов форелевого типа для инкубации икры нельмы позволяет уже на стадии формирования эмбриона увеличить ее выживаемость в среднем на 9%. Однако использование такого метода ограничено развитием сапролегнии, поражающей мертвые икринки. Из-за низкой проточности мертвая икра не выносится на поверхность, что затрудняет ее отбор и ведет к распространению сапролегнии на живую икру.
При средней температуре воды 5,0°C, продолжительность инкубации в форелевых аппаратах в наших опытах не превышала 2-х недель. В дальнейшем икра переносилась в стандартные аппараты Вейса на доинкубацию.
Инкубация икры нельмы в модифицированных аппаратах Вейса также позволяет увеличить выживаемость эмбрионов. Количество живой икры в них, в сравнении с использованием стандартных аппаратов, на стадии морулы было выше в среднем на 13%, а на этапе формирования эмбриона на 16%. Сравнительные данные по инкубации икры нельмы в различных аппаратах приведены в табл. 11.
Как и в случае с аппаратами форелевого типа, прекращение инкубации икры в модифицированных аппаратах Вейса в условиях рыбоводного хозяйства ООО «Форват» связано с поражением мертвой икры сапролегнией, что ограничивает использование опытных аппаратов семнадцатью днями. В дальнейшем из аппаратов вынималась решетка и продолжалась инкубация.
Последующие наблюдения за развитием икры нельмы в течение двух месяцев позволяли установить достоверную (при р ? 0,05) разницу в выживаемости икры между опытом и контролем в 15-16%.
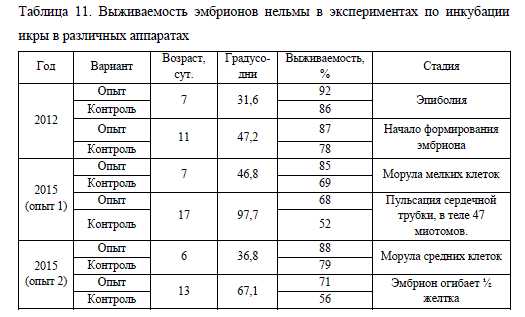
Как видно из таблицы 11, в эксперименте 2015 г. выживаемость икры на этапе развития эмбриона в опыте 1 и 2, имеет достаточно схожие значения, тогда как в 2012 г. количество живой икры на этапе начала формирования эмбриона была на 30% больше. На наш взгляд, на разницу в выживаемости икры в большей степени повлиял не способ инкубации, а достаточно теплые температурные условия, сложившиеся осенью 2015 г. В этот год наблюдалась высокая смертность икры и у других видов сиговых, инкубация которой также проходила на рыбоводном хозяйстве ООО «Форват».
Другой причиной, негативно отразившейся на выживаемости эмбрионов нельмы, явилось то, что икру в 2015 г. получали от самок, впервые участвующих в нересте. Как известно, половые продукты впервые созревших производителей сиговых рыб в аквакультуре имеют более низкое качество, чем повторно нерестящиеся рыбы (Шумилина, 2010а, 2010б; Якубец, 2010).
При сравнении результатов инкубации икры нельмы в аппаратах форелевого типа и модифицированных аппаратах Вейса было установлено, что более предпочтительным в использовании является второй вариант. Во-первых, доработка аппаратов не составляет большого труда; во-вторых, эти же аппараты используются для доинкубации икры; в-третьих, различия в выживаемости в опытных аппаратах в сравнении с контролем составляют 15-16%, в то время как при использовании аппаратов форелевого типа – 9%. Однако применение аппаратов, предназначенных для инкубации икры форели, имеет свои преимущества, среди которых - возможность инкубировать в 1,7 раз больше икры, чем в аппарате Вейса при одинаковом расходе воды.
Анализ выживаемости икры нельмы в эксперименте позволяет предположить, что этот вид достаточно чувствителен к механическому воздействию на ранних этапах эмбрионального развития. Следовательно, для целей воспроизводства необходима разработка методики инкубации икры нельмы в условиях с минимальным механическим влиянием, что существенно повысит эффективность рыбоводных мероприятий.
Подводя итог проведенным исследованиям по воздействию некоторых факторов внешней среды на эмбриональное развития кубенской нельмы, можно заключить, что наибольшее влияние на этот процесс оказывает температура воды, которая определяет скорость развития зародыша и его физиологические особенности.
Влияние на икру освещенности зависело от ее природы. Искусственное освещение в диапазоне от 7 до 150 лк не оказывало воздействия на скорость роста, выживаемость эмбрионов, а также на длительность инкубационного периода в сравнении с естественным освещением и развитием икры в темноте. С другой стороны, отмечены достоверные различия в количестве сегментов тела у эмбрионов, развивающихся в темноте и при свете, а в случае с естественным освещением - в показателях длины и массы.
Показано, что снижение механического воздействия на икру способно существенно повысить выживаемость зародышей нельмы на стадии органогенеза. Полученные результаты свидетельствуют о том, что икра нельмы, как и других видов сиговых рыб, на ранних этапах эмбрионального развития не обладает резистентностью к механическому воздействию.
Следует отметить, что исследования влияния освещенности на развитие икры нельмы, а также инкубации икры в аппаратах форелевого типа и модифицированных нами аппаратах Вейса, в практике рыбоводства были проведены впервые.
sibir.arktikfish.com
Подготовка икры сиговых рыб к инкубации
Подготовка оплодотворенной и набухшей икры сигов к инкубации включает обесклеивание (при необходимости) и профилактическую обработку для предупреждения грибковых заболеваний.
Обесклеивание икры сигов обычно проводят в емкостях, позволяющих обеспечивать ее постоянное движение. Для этого целесообразно использовать инкубационные аппараты Вейса или его модифицированные системы (Казанского, Чеза) с восходящим током воды. Использование этих аппаратов требует тщательного контроля за направлением в них потока воды и скорости течения, которые обеспечивали бы очень слабое движение икры (без «кипения»). «Кипение» икры обычно приводит к значительному увеличению смертности эмбрионов. При прекращении движения клейкая икра очень быстро образует комочки, препятствующие ее дальнейшей подготовке к инкубации. В качестве обесклеивающего вещества целесообразно использовать тальк, мел или обезжиренное молоко. При выборе обесклеивающего вещества следует учитывать, что тальк и мел утяжеляют икру и делают ее оболочки непрозрачными. Первое нежелательно при инкубации икры в аппаратах Вейса, а второе затрудняет наблюдение за развитием эмбрионов.
Для проведения обесклеивания икры готовится суспензия обесклеивающего вещества. Суспензию из талька и мела готовят следующим образом: 75-100 г талька (мела) и 8-11 г поваренной соли смешивают с пятью литрами чистой воды, полученную смесь хорошо перемешивают. На каждый килограмм икры необходимо использовать 0.5 л густой приготовленной смеси, которую разбавляют 4 л воды.
Для приготовления обесклеивающего вещества из обезжиренного молока в него добавляют поваренную соль из расчета 2-3 г поваренной соли на 1 л молока. Приготовленную смесь следует хорошо перемешать до полного растворения соли. Подготовленная таким образом смесь молока с поваренной солью вносится в икру для обесклеивания (5 л молочной смеси на 1 кг икры).
Обесклеивание заканчивается, если икринки не будут склеиваться. Обычно на эту операцию затрачивается до 45 минут. После этого икру следует хорошо промыть чистой водой.
Для выполнения профилактических мероприятий тщательно отмытую от суспензии икру подвергают воздействию дезинфицирующего раствора. Для этого используют раствор хлорамина в концентрации 1:30000 (экспозиция 20 мин) или перекись водорода в дозировке 500-1000 мг/л (экспозиция 15 мин). Для проведения профилактики икра размещается в эмалированном тазике с небольшим количеством воды. Затем в тазик с икрой вливается используемый дезинфицирующий раствор и в зависимости от его состава икра выдерживается в нем определенное время (15-20 мин). При проведении дезинфекции необходимо очень тщательно следить за содержанием в воде кислорода. При снижении его содержания менее 5 мг/л дезинфекцию следует прекратить, а икру тщательно промыть чистой водой и заложить в инкубационные аппараты, которые предварительно дезинфицируют свежим раствором хлорной извести.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Взятие зрелых половых продуктов у производителей, осеменение икры и подготовка ее к инкубации
Проверку производителей с целью готовности их половых продуктов для рыбоводных целей начинают за 2-3 часа до предполагаемого появления первых зрелых особей. Затем этот контроль над состоянием половых желез производителей продолжают осуществлять на протяжении всего периода их выдерживания в бассейнах.
У зрелых самцов сперма вытекает при самом легком массировании брюшка по направлению к генитальному отверстию или при слабом дугообразном изгибе спины. Зрелые самки, у которых прошла полная овуляция или большинство икринок овулировано, имеют мягкое брюшко.
При опускании этих самок вниз головой икра свободно переливается в полости тела, что можно наблюдать по перемещенью вздутия брюшка к голове.
При поднятии самок вверх головой или при легком массировании их брюшка в сторону задней части тела из генитального отверстия вытекает полостная жидкость с икрой.
По мере появления зрелых самок с овулированной икрой и зрелых самцов с текучей спермой их вынимают из бассейнов, помещают в брезентовые носилки с водой и доставляют в операционное отделение при инкубационном цехе, где берут у производителей зрелые половые продукты [1].
Зрелые половые продукты берут у производителя комбинированным способом. При этом способе основную часть половых продуктов берут у рыбы способом отцеживания, а оставшуюся часть – путем вскрытия брюшной полости. Во избежание ухудшения товарной ценности рыбы разрез делают вдоль боковой линии. При отборе половых продуктов у производителей следует избегать прямых солнечных лучей и яркого электрического освещения, температура воздуха должна быть близкой к температуре воды [1].
У самок сначала берут икру путем отцеживания. Перед взятием икры голову и хвостовой стебель обёртывают марлей. Если самка небольшая, икру отцеживает один человек. Он прижимает голову рыбы локтем левой руки к телу, а кистью этой руки держит хвостовой стебель в таком положении, чтобы генитальное отверстие находилось над краем чистой и сухой посуды (эмалированный таз с неотбитой эмалью или пластмассовый таз). Сдавив осторожно пальцами правой руки брюхо рыбы, проводят ими в направлении от головы к генитальному отверстию.
Зрелая икра свободно вытекает струёй в подставленный таз. Рыбу нужно держать таким образом, чтобы икра попадала на край подставленной посуды (нельзя допускать прямого попадания икринок с высоты более 1 см, так как они легко повреждаются).
Отцеживают икру до тех пор, пока не прекратится выделение свободных икринок. Нельзя брать икру с кровью.
Если самка крупная, то икру отцеживают два человека: один держит голову рыбы, другой держит над краем посуды хвостовой стебель и одновременно свободной рукой отцеживает икру.
Оставшуюся часть икры берут путем вскрытия брюшной полости, делая разрез вдоль боковой линии.
Икру отцеживают в сухие тазы. В один таз можно отцедить 3-4 кг икры [1].
Таким же способом берут и сперму у самцов. Существует очень удобный способ взятия спермы с помощью шприца для переливания крови ёмкостью 200-250 мл (АзНИИРХ). Наконечник из пластмассы или толстой оплавленной стеклянной трубки, соединённый гибким шлангом со шприцем, вводят в генитальное отверстие самца. Движением поршня создаётся вакуум, и сперма всасывается в цилиндр. Такой способ получения спермы обеспечивает стерильность операции и позволяет отбирать необходимое в данный момент количество спермы [1].
Сперма часто созревает отдельными порциями, поэтому её можно брать от самцов несколько раз. Для этого самцов после каждого отцеживания сажают в специальные садки для выдерживания, при котором созревает очередная порция спермы.
Так же сперму, если нужно, можно получить заранее. Для этого её отцеживают в сухую стеклянную посуду, лучше в пробирку, и сохраняют в термосе на льду при температуре около 1-2°C в течение 1-2 суток.
После получения половых продуктов, определения их качества, учёта — осеменяют икру. От способа осеменения зависит эффективность оплодотворения икры. Икру осеменяют смесью спермы от 3-5 самцов, что обеспечивает высококачественное оплодотворение. Обычно осеменение производят не позднее чем через 10-20 минут после взятия икры, так как задержка может привести к ухудшению её качества.
Для белорыбицы используют сухой способ осеменения. В таз отцеживают 3-4 кг икры, затем на икру выливают из пробирки сперму от 3-5 самцов из расчёта 2-2,5 мл спермы на 1 кг икры. Половые продукты осторожно и тщательно перемешивают рукой. Затем добавляют около 100 мл воды на 1 кг икры, вновь перемешивают и оставляют на 3-5 минут.
Инкубация икры
Инкубируют икру в аппаратах Вейса. Аппарат представляет собой стеклянный или из органического стекла сосуд, суживающийся книзу (перевёрнутая большая бутылка без дна). Верхние края сосуда обтянуты обручем из оцинкованного железа. Нижнее отверстие аппарата закрыто пробкой с ввёрнутой в центре металлической трубкой диаметром 0,8-1 см. Наружный конец этой трубки соединён резиновым шлангом, по которому поступает в аппарат вода из водопроводного крана. Чтобы не было мёртвого пространства над пробкой, у стенок сосуда, где отсутствует ток воды, это место заполняют воском или менделеевской замазкой. Пробке придают нужную вогнутую форму. Токи воды, идущие из водопроводного края, поступают под напором в нижнюю часть сосуда и поднимают вверх помещённую в аппарат икру. В верхней части сосуда напор воды ослабевает, поэтому икринки начинают постепенно опускаться в нижнюю часть его, где подхватываются струями воды и вновь увлекаются вверх. Так на протяжении всего периода инкубации икра находится в непрерывном движении в толще воды. Сброс воды из аппарата происходит через сливной носик, сделанный в железном обруче, обтягивающем верхние края сосуда [1].
Аппарат Вейса устанавливают в стойке, имеющей два гнезда, одно из которых удерживает нижнюю часть, а другое — среднюю часть сосуда. Причём аппарат должен стоять обязательно в строго вертикальном положении. В противном случае струи воды будут направляться по одной стороне сосуда, что может вызвать неравномерное вращение икринок и заморы в отдельных частях аппарата. Аппараты Вейса обычно монтируют по 10-40 шт. на одной стойке, причём для каждого из них обязательно независимое водоснабжение. Сброс воды из аппаратов осуществляется первоначально в общий водосбросной лоток, лежащий под стойкой, а из него в канализационную сеть. Для задержки икры в момент отключения водоподачи используют обратный клапан. Расход воды в аппарате 2-4 л/мин (рис. 21) [1].
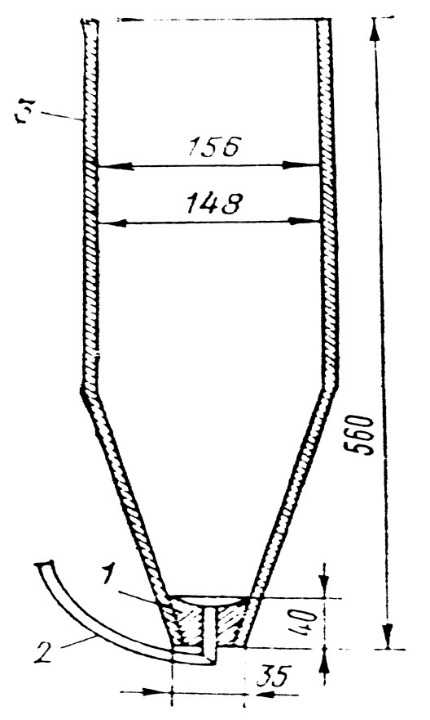
1 – стеклянный сосуд; 2 – металлическая трубка; 3 – пробка; 4 – водоподающий шланг.
Рисунок 21 – Инкубационный аппарат Вейса [1]
При получении икры, осеменении, отмывке и инкубации желательно не смешивать икру от разных самок, так как при разном качестве икры выход предличинок из икры лучшего качества при смешивании будет ниже из-за развития сапролегнии.
Кроме того, при определении количества икры, которое нужно загружать в один аппарат, необходимо вносить поправку на число эмбрионов в 1 г, так как потребление кислорода и интенсивность обменных процессов определяется не только общей массой икры, но и её количеством. Другими словами, закладывать икру в инкубационный аппарат нужно исходя из количества, а не из её массы. Норма загрузки икры в инкубационные аппараты 200 тыс. штук. Перегрузка аппаратов икрой влечёт за собой отставание в развитии, повышает процент уродов и увеличивает отход [1].
Инкубация икры в аппаратах Вейса должна проходить при температуре воды от 0,1 до 3 °C. Продолжительность развития эмбрионов в аппарате около 5 месяцев. Выклев предличинок происходит в первой половине апреля при температуре 4-6 °C. Освещение во время инкубации ограничивается, так как является губительным для эмбрионов. Отход за период инкубации не должен превышать 10 % [2].
Уход за икрой в период инкубации заключается в наблюдении за температурой, концентрацией кислорода, диоксида углерода, pH, проточностью, уровнем воды, световым режимом, состоянием эмбрионов: отбор мёртвых эмбрионов (специальным пинцетом, грохотками, грушами, сифоном), профилактической обработке по мере необходимости. Мёртвые икринки отличаются беловатым цветом. Отбор мёртвых эмбрионов, нужно проводить в периоды пониженной чувствительности [1].
Для повышения жизнестойкости рыб в раннем онтогенезе используют нейропептиды. Таким нейропептидом является - даларгин. В настоящее время в России он производиться промышленностью, и легкодоступен. Этот пептид повышает выживаемость икры, предличинок, личинок и молоди рыб, ускоряет темп роста, что приводит к увеличению прироста ихтиомассы выращиваемой рыбы, снижению затрат кормов, себестоимости рыбы. Воздействие даларгина в раннем эмбриогенезе увеличивает выживаемость эмбрионов и личинок на 10-69 %.
Так же используется низкоинтенсивное лазерное излучение, которое позволяет повысить эффективность инкубации икры. Лазерное излучение, также как и синтетические нейропептиды, пример многофункционального экзогенного регулятора. Воздействие лазера на сиговых и других рыб приводит к ускорению и синхронизации эмбриогенеза, стимуляции роста эмбрионов, увеличению их выживаемости, снижению доли аномальных предличинок после облучения неоплодотворённой икры, предотвращению развития сапролегниоза. Так, например, масса тела эмбрионов увеличивается на 13-38 %, их длина — на 3—8 %, уменьшается продолжительность вылупления в 2,0-2,5 раза, повышается выживаемость в 2-3 раза. Наиболее эффективное положительное действие оказывает красное излучение гелий-неонового лазера (632 нм) по сравнению с синим, зелёным и ультрафиолетовым [1].
Инкубация икры в аппаратах Вейса при температуре 0,5-6,5 °C составит 195-120 дней [1].

Рисунок 22 – Инкубационный цех [2]
Выдерживание предличинок
Вылупление предличинок происходит в первой половине апреля, при температуре 4-6 °C и продолжается несколько суток. Предличинки белорыбицы имеют жировую каплю в небольшом желточном мешке. У них хорошо развиты грудные плавники. Держатся предличинки в стае, не боятся света. Вылупившиеся предличинки из аппаратов Вейса с током воды попадают в жёлоб и переносятся в сетчатые садки-питомники, установленные в бассейнах для выдерживания производителей. Предличинок выдерживают в садках при плотности посадки от 150 до 200 тыс. шт. Через 3—4 дня предличинки становятся личинками, которые переходят на смешанное питание [2].
stydopedia.ru
Способ перемешивания икры рыб в процессе ее инкубации в аппаратах вейса
№ 131586
Класс 4511, 24о1
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Подписная группа ¹ 188
А.,В. Кузнецов
СПОСОБ ПЕРЕМЕШИВАНИЯ ИКРЫ РЫБ В ПРОЦЕССЕ ЕЕ
ИНКУБАЦИИ В АППАРАТАХ «ВЕЙСА»
Заявлено 20 января 1960 г. за № 661293/28 в Комитет по делам изобретений и открытий при Совете Министров СССР
Опубликовано в «Бюллетене изобретений» № 17 за 1960 г.
Известны способы перемешивания икры рыб в аппаратах «Вейса» .в период ее инкубации, осуществляемые с помощью деревянных мешалок.
Описываемый способ отличается от известных тем, что перемешивание икры осуществляется гидравлическим путем и состоит в том, что к внутренней поверхности аппарата подводится, например, при помощи стеклянной трубки с резиновым наконечником струя воды в несколько приемов, чем достигается быстрое и качественное перемешивание икры и исключаются механическое воздействие на икру и ее потери.
На чертеже изображена схема гидравлического перемешивания икры в аппарате «Вейса».
Над водопадающим верхним лотком 1 на высоте около 200 мм от уровня воды в лотке крепится трос (проволока) 2, на котором установлен передвигающийся держатель 3 для шланга-сифона 4 с внутренним диаметром 14 — 16 »1м. В длинный конец шланга-сифона вставляется стеклянная трубка 5 с резиновым наконечником б. К держателю 8 крепится рычаг 7 для передвижки шланга-сифона 4 по поддерживающему тросу 2.
Процесс перемешивания икры осуществляется следующим образом.
Зажимается шланг 8 зажимом Гофмана 9 (или рукой), чем прерывается поступление воды снизу в аппарат «Вейса» 10 и одновременно погружается наконсчник стеклянной трубки 5 в воду над уровнем икры. На этом уровне обводят наконечником и омывают выходящей из него струей воды внутреннюю поверхность аппарата по всему периметру, очищая внутреннюю стенку аппарата от прилипшей икры, затем наконечник погружают на тлубину действия предыдущей струи воды и повторяют тот же прием.
Так действуют до тех пор, пока не достигнут основания аппарата, при этом вся масса икры перемешивается. № 131586
Предмет изобретения
Способ перемешивания икры рыб в процессе ее инкубации в аппаратах «Вейса», отл и ч а ю щи йся тем, что, с целью более качественного перемешивания и устранения при этом механических повреждений и потерь икры, перемешивание производят струей воды путем воздействия ею на внутреннюю поверхность инкубационного аппарата, причем струю воды вначале подводят к стенке аппарата непосредственно над уровнем икры в нем и на этом уровне омывают внутреннюю поверхность аппарата по всему периметру, а затем повторяют этот прием, последовательно опуская струю воды в слой икры на глубину предыдущего действия струи.
Редактор В. В. Хазова Техред А. А. Камышникова Корректор Б. А. Шнейдерман
Поди. к печ. 2.Х1-60 г. Формат бум. 70 (108 />6 Объем 0,17 п. л.
Зак. 8973 Тираж 650 Цена 25 коп.; с 1.1-61 r. — 3 коп.
ЦБТИ при Комитете по делам изооретений и открытий при Совете Министров СССР
Москва, Центр, М. Черкасский пер., д. 2/6
Типография ЦБТИ Комитета по делам изобретений и открытий при Совете Министров СССР, Москва, Петровка, 14.
www.findpatent.ru