Содержание
§ 5. Обработка осетровой рыбы
Осетровая рыба
отличается от других видов рыб тем, что
не имеет костного скелета и поверхность
её покрыта несколькими рядами костных
пластинок-жучек.
На предприятия
общественного питания эта рыба чаще
всего поступает в мороженом виде.
Осетровая рыба поступает без внутренностей,
которые удаляют при промышленной
обработке в процессе получения икры.
Осетровую рыбу оттаивают на воздухе,
уложив на столы или стеллажи в рыбном
цехе брюшной частью вверх, чтобы из
рыбы не вытекал образующийся при этом
сок. Рыбу считают оттаявшей, если она
станет мягкой и внутри на разрезе не
будет видно кристаллов льда.
Обработку крупной
осетровой рыбы – белуги, севрюги,
осетра, шипа, калуги – производят
одинаковым способом (рис. 7).
Рис 7 Схема обработки
осетровой рыбы
Вначале отрубают
голову вместе с грудными плавниками.
Для этого оттягивают грудной плавник
и большим поварским ножом прорезают
под плавником кожу и мякоть до хряща с
двух сторон. Затем перерубают соединяющий
хрящ и отделяют голову. После этого у
рыбы срезают спинные костные жучки
вместе с полоской кожи в направлении
от хвоста к голове и удаляют плавники.
Иногда хвостовой плавник не отрезают
до удаления визиги – плотного хряща,
заменяющего осетровым рыбам позвоночник.
При этом у хвоста надрезают мякоть
вокруг визиги и вытягивают её вместе
с хвостом осторожно, чтобы не порвать.
Можно также
отрезать хвост и, поддев визигу при
помощи поварской иглы с хвостовой
стороны или изнутри рыбы, вытянуть
рукой. Иногда визигу удаляют после
пластования рыбы. В некоторых случаях
рыба поступает без визиги, которую
удаляют одновременно с внутренностями
при промышленной обработке.
Рыбу пластуют,
разрезают вдоль по середине жировой
прослойки на спине и получают две
половины, называемые звеньями. У крупной
У крупной
рыбы, особенно белуги, каждое звено
разрезают на несколько частей в длину
и ширину так, чтобы масса кусков была
не более 4 – 5 кг, а длина до 60 см.
Для облегчения
дальнейшей очистки рыбы от костных
жучек звенья осетровой рыбы ошпаривают,
погружая их кожей вниз в рыбный котел
или специальную ванну с горячей водой
на 3 мин. Причем воды берут такое
количество, чтобы в нее была погружена
лишь нижняя часть звена с кожей, а мякоть
находилась над водой. Затем звено
вынимают из воды, перекладывают на стол
кожей вверх и быстро соскабливают ножом
с поверхности рыбы боковые, брюшные и
мелкие костные жучки.
После зачистки
рыбу промывают холодной водой, смывая
при этом образовавшиеся на поверхности
сгустки белка. В результате ошпаривания
звеньев осетровой рыбы их масса
уменьшается на 5–10%.
Подготовленные
таким образом звенья используют в целом
виде для варки. У них подвертывают
брюшную часть и перевязывают звенья
шпагатом для того, чтобы они сохранили
свою форму, а затем кладут на решетку
рыбного котла. Кроме того, удобно
Кроме того, удобно
пользоваться специальным приспособлением,
состоящим из проволочной решетки с
зажимами, на которую помещают звено.
При использовании
звеньев осетровой рыбы для припускания
или жарки в целом виде у них вначале
срезают хрящи, а затем ошпаривают и
зачищают от жучек. При такой обработке
рыбы количество отходов составляет
33–36%.
Обработанные,
ошпаренные и зачищенные от хрящей
звенья осетрины, севрюги и белуги
нарезают на порционные куски с кожей
или без кожи, которые используют для
припускания, жарки и запекания.
Звено укладывают
на доску кожей вниз и, начиная с хвоста,
нарезают на порции кусками в 1 – 1,5 см
толщиной поперек волокон, держа нож
под углом в 30°, прорезая или не прорезая
кожу. Порционные куски ошпаривают,
опуская их в горячую воду (95 °С) на 1–2
мин. Воды при этом берут в 3–4 раза
больше, чем рыбы. Ошпаренные куски
вынимают и промывают холодной водой,
чтобы смыть выступившие сгустки белка.
В процессе ошпаривания рыба уменьшается
в объеме и уплотняется, поэтому при
тепловой обработке она хорошо сохраняет
свою форму и при жарке от нее не отстает
панировка.
Воду, которой
вторично ошпаривают рыбу, можно
использовать для приготовления бульонов.
Обработку стерляди
для приготовления блюд из целой рыбы
начинают с удаления боковых, брюшных
и мелких костных жучек. Разрезают
брюшко, вынимают внутренности, удаляют
визигу и промывают жабры. Спинные жучки
оставляют, так как при удалении их можно
повредить мякоть рыбы. После варки или
припускания рыбы их легко снимают.
Количество отходов при обработке
стерляди до 42%.
Обработка и использование рыбных отходов — Студопедия
Поделись
Хек
Миноги.
Бельдюгa.
Сом.
Рыбу зачищают ножом от слизи. У мелких экземпляров отрезают голову, плавники, а затем потрошат и промывают. У крупных экземпляров кожу предварительно снимают «чулком».
У крупных экземпляров кожу предварительно снимают «чулком».
Тело рыбы крyглое, сужено к хвосту и покрыто peдкими, еле заметными на темной коже мелкими чешуйками. Кожа гpубая, поэтому ее удаляют, снимая «чулком», как у налима.
Эту рыбу не потрошат. Слизь, которой покрыта рыба, необходимо удалить. Для этого тушку тщательно протирают солью и хорошо промывают.
Навага.
Мороженую навагу разделывают, не размораживая. У мелких экземпляров отрезают нижнюю челюсть с частью брюшка, потрошат через образовавшееся отверстие, оставляя в тушке икру, прорезают кожу вдоль позвоночника, снимают ее с обеих сторон тушки, начиная с головы, после чеrо удаляют спинной плавник. У крупной рыбы отрубают голову, потрошат, надрезают кожу вдоль спины, вырезают спинной плавник и снимают кожу по
направлению от спины к брюшку. Крупную рыбу пластуют.
Треска, пикша.
Тресковые обычно поступают без головы и внутренностей. В этом случае их обработка заключается в yдaлени и черной пленки (на брюшной полости), очистке от чешуи и промывании.
(серебристый и тихоокеанский). У рыбы снимают пленку с брюшной полости. Мелкие экземпляры (массой до 250 г) разделывают целиком тушкой и используют для жаренья. Крупные экземпляры разделывают, не пластуя, и режут на порционные куски. Кожа у хека гpубая и ее лучше снимать.
Рыба сабля. Рыба имеет плоское тело, поэтому ее не пластуют и не разделывают на филе. Поступает рыба потрошеной. У нее зачищают черную пленку и, начиная с хвостовой части, срезают со спины и брюшка плавники вместе с полоской мякоти. Обработанную тушку нарезают на порционные куски под прямым yглом.
Разделка рыбы для фарширования.
Фаршируют рыбу целиком (судак, щука, сазан, карп, треска), порционными кусками и в виде батона. Для фарширования целиком судака очищают от чешуи, стараясь не повредить кожу. Затем отрубают плавники, делают глубокие надрезы на спине, прорезая реберные кости вдоль позвоночника. После этого разламывают или перерезают позвоночник у хвоста и головы и удаляют eгo. Таким образом, на спине рыбы образуется отверстие от головы до хвоста, через которое удаляют внутренности. Рыбу тщательно промывают. Тонким ножом cpeзают мякоть и реберные кости, оставляя на коже слой мякоти не более 0,5 см. Плавники и кости внутри рыбы вырезают ножницами. Из головы удаляют жабры и глаза. Тщательно промытую рыбу наполняют фаршем, заворачивают в чистую марлю, перевязывают шпагатом и направляют на тепловую обработку.
Таким образом, на спине рыбы образуется отверстие от головы до хвоста, через которое удаляют внутренности. Рыбу тщательно промывают. Тонким ножом cpeзают мякоть и реберные кости, оставляя на коже слой мякоти не более 0,5 см. Плавники и кости внутри рыбы вырезают ножницами. Из головы удаляют жабры и глаза. Тщательно промытую рыбу наполняют фаршем, заворачивают в чистую марлю, перевязывают шпагатом и направляют на тепловую обработку.
Для фарширования целиком рыбу можно разделать иначе: щуку осторожно очищают от чешуи, вокруг головы надрезают кожу и концом ножа отделают ее от мякоти. Затем левой рукой держат рыбу полотенцем за голову, другой рукой захватывают кожу и снимают ее «чулком» по направлению от головы к хвосту, подрезая ножом или ножницами мякоть у плавников. У caмогo хвоста мякоть и позвоночную кость перерезают и получают две части: вывернутую кожу с хвостом и тушку.
Кожу хорошо промывают, а тушку потрошат, промывают и отделяют мякоть от костей. Мякоть используют для приготовления фарша. Затем кожу наполняют фаршем, приставляют обработанную голову, заворачивают в марлю, перевязывают шпагатом и нaправляют на тепловую обработку.
Затем кожу наполняют фаршем, приставляют обработанную голову, заворачивают в марлю, перевязывают шпагатом и нaправляют на тепловую обработку.
Сазана, карпа и треску фаршируют порционными кусками. непластованную рыбу нарезают на кругляши толщиной примерно 5 см. Концом ножа вырезают мякоть с обеих сторон позвоночника так, чтобы на коже остался слой мякоти толщиной 0,3 … 0,5 см. Отверстие наполняют фаршем и подготовленную рыбу направляют на тепловую обработку. При массовом изготовлении рыбу фаршируют в виде батона, для этого используют речную и океаническую рыбу, в мышцах которой мало костей. При этом часть рыбы разделывают на филе без реберных костей, а часть на чистое филе, которое используют для приrотовления фарша. На целлофан кладут филе кожей вниз, а на него рыбный фарш, сверху закрывают eгo филе кожей вверх. Сформованные батоны плотно обертывают целлофаном, перевязывают шпаrгатом и направляют на тепловую обработку. Для приготовления фарша филе рыбы дважды измельчают на мясорубке вместе с пшеничным хлебом (без корок), замоченным в молоке или воде, пассерованым луком и чесноком. В фарш дoбавляют размягченный маргарин, яйца, соль, молотый перец и перемешивают до однородной консистенции. Можно использовать замороженный рыбный фарш промышленной выработки.
В фарш дoбавляют размягченный маргарин, яйца, соль, молотый перец и перемешивают до однородной консистенции. Можно использовать замороженный рыбный фарш промышленной выработки.
Схема разделки рыбы с хрящевым скелетом
Рыба осетровых пород, за исключением стерляди поступает мороженой и полностью потрошеной. Обработка ее включает размораживание, удаление голов, спинных жучков, плавников, визиги, пластование, ошпаривание и зачистку (рис. ). У размороженных тушек отрубают голову вместе с гpудными
плавниками и костями плечевого пояса двумя косыми срезами вдоль жаберных крышек. После этого у рыбы срезают спинные жучки со спинным плавником, удаляют анальный, брюшной плавники по линии их основания, отделяют хвостовой плавник по прямой линии перпендикулярно к позвоночнику на уровне начала лучей и удаляют визигy — плотный хрящ, заменяющий осетровым рыбам позвоночник. Иногда хвостовой плавник не отрезают до удаления визиги. При этом у хвоста надрезают мякоть вокpyг визиги и вытягивают ее вместе с хвостом, осторожно, чтобы не порвать. Извлечь визигy можно и дрyrим способом после пластования рыбы, но при этом она может быть повреждена.
Извлечь визигy можно и дрyrим способом после пластования рыбы, но при этом она может быть повреждена.
В некоторых случаях рыба поступает без визиги, которую удаляют одновременно с внутренностями при промышленной обработке. Рыбу пластуют, разрезая вдоль по середине жировой прослойки на спине на две половинки- звенья. Крупные звенья разрезают в продольном и поперечном направлениях так, чтобы длина куска не превышала 60 см, а масса 4- 5 кг.
Для облегчения дальнейшей очистки рыбы от костных жучков звенья ошпаривают, погpужая их кожей вниз в горячую воду на 2-3 мин. Воды
берут такое количество, чтобы в нее была погpужена лишь нижняя часть звена с кожей, а мякоть находилась над водой. Затем звено быстро очищают от боковых, брюшных жучков и мелких костных образований, удаляют брюшную пленку. Дальнейшая обработка звеньев зависит от их кулинарноrо использования.
Для варки целиком звенья после ошпаривания и зачистки жучков промывают, подвертывают тонкую брюшную часть, перевязывают шпагатом для лучшеrо сохранения формы. В результате ошпаривания масса звеньев уменьшается на 5 … 10 %. При использовании звеньев осетровой рыбы для припускания или жарки в целом виде либо порционными кусками с кожей или без кожи у них сначала срезают хрящи, затем ошпаривают и зачищают от жучков. Порционные куски перед тепловой обработкой ошпаривают еще раз, опуская на 1-2 мин в воду при 95 — 97 0С (3 …4 л на 1 кг рыбы). После ошпаривания куски промывают в воде, чтобы смыть выступившие сгyстки белка. В процессе ошпаривания рыба уменьшается в объеме и уплотняется,
В результате ошпаривания масса звеньев уменьшается на 5 … 10 %. При использовании звеньев осетровой рыбы для припускания или жарки в целом виде либо порционными кусками с кожей или без кожи у них сначала срезают хрящи, затем ошпаривают и зачищают от жучков. Порционные куски перед тепловой обработкой ошпаривают еще раз, опуская на 1-2 мин в воду при 95 — 97 0С (3 …4 л на 1 кг рыбы). После ошпаривания куски промывают в воде, чтобы смыть выступившие сгyстки белка. В процессе ошпаривания рыба уменьшается в объеме и уплотняется,
поэтому при тепловой обработке ее форма сохраняется и при жарке от нее не отстает панировка. Воду, в которой вторично ошпаривают рыбу, можно использовать для пригoтовления бульонов.
Стерлядь после размораживания, не ошпаривая, очищают от жучков, разрезают брюшко, удаляют внутренности, жабры и визигy. У стерляди, предназначенной для припускания в целом виде, спинные жучки отделяют после тепловой обработки, а у стерляди, предназначенной для варки, припускания, жарки порционными кусками, до нее. Для приготовления порционных кусков потрошеную стерлядь пластуют после удаления спинных жучков, а затем нарезают поперек. Количество отходов при обработке стерляди составляет 42 %.
Для приготовления порционных кусков потрошеную стерлядь пластуют после удаления спинных жучков, а затем нарезают поперек. Количество отходов при обработке стерляди составляет 42 %.
Приготовление рыбных котлетной и кнельной массжелательно из рыбы с небольшим количеством костей (rгoрбуша, рыба-капитан, кета, мерлуза, серебристый хек, сом, cyдак, щука, хариус и др.). Рыбу разделывают на филе с кожей без костей или без кожи и костей (для кнельной массы).
Котлетная масса может быть пригoтовлена из охлажденной, размороженной и из хорошо вымоченной соленой рыбы.
Филе нарезают кусками, добавляют замоченный в молоке или воде черствый пшеничный хлеб из муки не ниже 1-гo сорта (без корок), соль, перец, хорошо перемешивают, про пускают через мясорубку, после чего снова перемешивают и выбивают.
Если котлетная масса не вязкая (из трески, хека, пикши и др.), то в нее добавляют сырое яйцо. В слишком вязкую котлетную массу для увеличения рыхлости кладут пропущенную через мясорубку охлажденную вареную рыбу в количестве 25 . .. 30 % массы мякоти сырой рыбы. В котлетную массу можно добавить молоки свежей рыбы, но не более 6 % от массы мякоти. Из котлетнои массы приготавливают котлеты, биточки, тефтели, хлебцы рыбные, рулеты, зразы, тельное. Для котлетной массы, из которой готовят тефтели, хлеб берут в меньшем количестве, вводят пассерованный репчатый лук, пропущенный через мясорубку вместе с замоченным пшеничным хлебом. Для
.. 30 % массы мякоти сырой рыбы. В котлетную массу можно добавить молоки свежей рыбы, но не более 6 % от массы мякоти. Из котлетнои массы приготавливают котлеты, биточки, тефтели, хлебцы рыбные, рулеты, зразы, тельное. Для котлетной массы, из которой готовят тефтели, хлеб берут в меньшем количестве, вводят пассерованный репчатый лук, пропущенный через мясорубку вместе с замоченным пшеничным хлебом. Для
хлебцов рыбных готовят котлетную массу (с хлебом) и вводят в нее размягченное сливочное масло, яичные желтки, соль, перец и тщательно вымешивают. Затем добавляют, осторожно перемешивая, взбитые яичные белки. готовую массу выкладывают в смазанные маслом формы, заполняя их на 2/3 высоты. Котлетам придают овально-приплюснyтyю форму с одним заостренным концом; биточкам крyглоприплюснyтyю форму, панируют изделия в сухарной панировке. Тефтели формуют в виде шариков диаметром 3-4 см по 3 — 5 шт. на порцию и панируют в муке. Для приготовления рулета котлетную массу раскладывают на мокрую ткань или целлофан в виде прямоугольника слоем толщиной 1,5-2 см. На середину прямоyгольника в продольном направлении помещают фарш и, приподнимая концы, соединяют края котлетной массы (встык). Pyлет перекатывают на смазанный маслом противень швом вниз, смазывают льезоном, посыпают сухарями, сбрызгивают маслом
На середину прямоyгольника в продольном направлении помещают фарш и, приподнимая концы, соединяют края котлетной массы (встык). Pyлет перекатывают на смазанный маслом противень швом вниз, смазывают льезоном, посыпают сухарями, сбрызгивают маслом
и делают несколько проколов, чтобы образующиеся при тепловой обработке пары не разорвали оболочку.
Для приrотовления тельного котлетную массу укладывают на мокрую ткань или целлофан в форме лепешки, на середину которой помещают фарш. Лепешку складывают вдвое, придавая тельному форму полумесяца. Смачивают полуфабрикат в льезоне и панируют в сухарях. Рыбные зразы rотовят из котлетной массы, формуя в виде овала. Свежие или сушеные гpибы для фарша отваривают (сушеные предварительно замачивают) и рубят. Репчатый лук шинкуют соломкой и пассеруют. Зелень укропа или петрушки мелко рубят. Все продукты соединяют, добавляют сухарную крошку, соль, молотый перец и хорошо перемешивают. В фарш можно добавлять мелко нарезанные крутые яйца, а также шинкованную отварную визигу и разваренные хрящи осетровых рыб. Биточки и котлеты можно готовить без хлеба. Для этого филе
Биточки и котлеты можно готовить без хлеба. Для этого филе
рыбы без кожи и костей нарезают на куски, посыпают солью, перцем, добавляют измельченный репчатый лук, перемешивают и пропускают через мясорубку с крупной решеткой. Из полученной массы формуют котлеты, смачивают их в льезоне и панируют в белой панировке. Кнельную массу используют для приrотовления нежных и рыхлых изделий. Рыбное чистое филе и черствый пшеничный хлеб (без корок), замоченный в молоке, два-три раза пропускают вместе через мясорубку с очень мелкой решеткой. Затем массу протирают, добавляют яичные белки и хорошо взбивают, подливая молоко или сливки. Хорошо взбитая масса плавает на поверхности воды. По окончании взбивания массу солят. Bместо черствого пшеничного хлеба можно использовать пресное слоеное или заварное тесто. Кнельную массу разделывают в виде клецок и варят в подсоленой воде. Используют ее и для приготовления холодных блюд (буше), а также для фарширования рыбы.
Централизованное производство рыбных полуфабрикатов организовано на рыбокомбинатах, в рыбных цехах крупных фабрик-кухонь и предприятий загoтовочных на механизированных поточных линиях.
Для выработки полуфабрикатов используют охлажденную и мороженую рыбу. Централизованно вырабатывают рыбу потрошеную с головой
и обезглавленную, в виде полуфабриката «рыба специальной разделки» и в виде рыбного филе и рыбноro фарша. Порционные и мелкокусковые полуфабрикаты централизованно не вырабатывают в связи со слабой влагoудерживающей способностью мьпнечной ткани рыбы и связанными с этим значительными потерями сока при транспортировке и хранении полуфабрикатов.
Схема технолоrическоro процесса производства полуфабриката «рыба специальной разделки» в охлажденном виде состоит из следующих операций: размораживание сырья, разделки, промывания, фиксации и охлаждения и упаковки. В процессе фиксации мышечная ткань быстро охлаждается, поверхностный слой насыщается солью. При этом увеличивается влагoудерживающая способность белков и на 5 -12 % уменьшаются потери массы полуфабриката при хранении, транспортировани и и порционировании. Вследствие повышенногo содержания соли в мышечном слое снижается температура замерзания, что позволяет хранить рыбу при температуре от l — 2 0С без подмораживания.
После фиксации рыбу охлаждают в холодильной камере. Полуфабрикаты выпускают в виде тушки без гoловы; без чешуи, плечевой кости, икры или молок; с зачищенной брюшной полостью. Хвостовой плавник удален прямым срезом на уровне 1-2 см выше конца кожноro покрова, остальные плавники на уровне кожноrо покрова.
Упаковывают полуфабрикаты в пластиковые ящики, или в металлические ящики с крышками. Рыбу специальной разделки мороженую получают по той же схеме, что и для полуфабриката «рыба охлажденная», но рыбу не подвергают фиксации. Мороженая рыба выпускается в виде тушек без головы, чешуи и внутренностей. Крупную рыбу разделывают на куски- звенья по длине тары или на куски массой от 200 г до 1 кг. Рыбу замораживают поштучно блоками до 14 кг. Мороженую рыбу упаковывают в ящики, пакеты из пленки массой от 1 — 40 кг.
Рыбный фарш приготавливают из рыбы, имеюшей незначительное количество мелких внутри мышечных костей. Филе рыбы без кожи и костей пропускают через мясорубку с диаметром отверстий 2 мм, затем выкладывают на охлажденные противни слоем не выше 2 см и ставят в холодильник. Рыбный фарш массой до 10 кг плотно упаковывают в пакеты из пленки. Филе рыбы выпускают в виде замороженных блоков, в которых мякоть может быть с кожей и без кожи, но без реберных костей.
Рыбный фарш массой до 10 кг плотно упаковывают в пакеты из пленки. Филе рыбы выпускают в виде замороженных блоков, в которых мякоть может быть с кожей и без кожи, но без реберных костей.
При кулинарной обработке рыбы получают отходы в количестве от 15 до 60 % в зависимости от вида рыбы, способа кулинарной обработки и дрyгих факторов. Отходы, получаемые в ходе механической кулинарной обрабтки рыбы, сортируют на пищевые и непищевые. К пищевым отходам относят головы без жабр, икру, молоки, внутренний жир, плавники (в том числе хвостовой), кожу, кости, чешую, а также визигy и хрящи осетровых рыб. Рыбные отходы тщательно промывают. Головы с удаленными жабрами и глазами используют для варки бульонов. Головы осетровых рыб перед варкой дополнительно обрабатывают: ошпаривают и зачищают от костных щитков, после чего разрубают, вырезают жабры, промывают и варят около 1,5 ч. После этого отделяют хрящи и мясо от костей. Мясо используют для cyпов, студней, фаршей. Хрящи заливают горячей водой и продолжают варить до мягкости, после чеrо шинкуют и используют в качестве дополнительноrо гарнира в солянки, соусы и для приготовления фаршей.
Молоки и икру используют для приготовления форшмаков и запеканок. Молоки можно добавлять в рыбную котлетную массу из тощих рыб. Икру используют также для осветления рыбных бульонов, икру и молоки солят или маринуют с уксусом, луком, перцем и подают как холодные закуски. Стерляжью икру приготовляют мало-соленой: сразу же после разделки стерляди икру освобождают от оболочки (ястыка), добавляют соль (не более 3 % от массы икры) и оставляют в холодильнике на 12 ч. Визигy разрезают вдоль, освобождают от внутренней хрящевидной массы, тщательно промывают и используют для фаршей. При централизованной переработке осетровых рыб визигy заготавливают впрок, высушивая до влажности 16 … 20 %. Чешую используют для приготовления желированных блюд. Ее промывают, заливают трехкратным количеством воды и варят 2 ч. Отвар процеживают и осветляют. При охлаждении он обра зует прозрачное желе. Отвары из чешуи заменяют желатин приприготовлении рыбных заливных блюд. Из всех отходов рыбы наибольшую пищевую ценность имеет икра благодаря значительному содержанию белка, жира, витаминов. Исключение составляет икра некоторых рыб семейства карповых: усача, маринки, османов она ядовита и в пищу не используется.
Исключение составляет икра некоторых рыб семейства карповых: усача, маринки, османов она ядовита и в пищу не используется.
Эволюция генов биогенеза микроРНК у стерляди (Acipenser ruthenus) и других полиплоидных позвоночных
1. Оно С. Эволюция путем дупликации генов. Спрингер; Берлин, Гейдельберг: 1970. [Google Scholar]
2. Дехал П., Бур Дж. Л. Два раунда полногеномной дупликации у предков позвоночных. PLoS биол. 2005;3:e314. doi: 10.1371/journal.pbio.0030314. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Накатани Ю., Такеда Х., Кохара Ю., Моришита С. Реконструкция предкового генома позвоночных выявляет динамическую реорганизацию генома у ранних позвоночных. Геном Res. 2007; 17: 1254–1265. doi: 10.1101/gr.6316407. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Hoegg S., Brinkmann H., Taylor J.S., Meyer A. Филогенетические сроки дупликации генома рыб коррелируют с диверсификацией костистых рыб. Дж. Мол. Эвол. 2004; 59: 190–203. doi: 10.1007/s00239-004-2613-z. [PubMed] [CrossRef] [Google Scholar]
Дж. Мол. Эвол. 2004; 59: 190–203. doi: 10.1007/s00239-004-2613-z. [PubMed] [CrossRef] [Google Scholar]
5. Мейер А., Ван де Пир Ю. От 2R к 3R: доказательства специфической дупликации генома рыб (FSGD) Bioessays. 2005; 27: 937–945. doi: 10.1002/bies.20293. [PubMed] [CrossRef] [Google Scholar]
6. Glasauer S.M.K., Neuhauss S.C.F. Полногеномная дупликация костистых рыб и ее эволюционные последствия. Мол. Жене. Геномика. 2014;289: 1045–1060. doi: 10.1007/s00438-014-0889-2. [PubMed] [CrossRef] [Google Scholar]
7. Lien S., Koop B.F., Sandve S.R., Miller J.R., Kent M.P., Nome T., Hvidsten T.R., Leong J.S., Minkley D.R., Zimin A., et al. Геном атлантического лосося дает представление о редиплоидизации. Природа. 2016; 533: 200–205. doi: 10.1038/nature17164. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Чен З., Омори Ю., Корен С., Широкия Т., Курода Т., Миямото А., Вада Х., Фудзияма А. , Тойода А., Чжан С. и др. Сборка золотых рыбок de novo ( Carassius auratus ) геном и эволюция генов после полногеномной дупликации. науч. Доп. 2019;5:eaav0547. doi: 10.1126/sciadv.aav0547. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
науч. Доп. 2019;5:eaav0547. doi: 10.1126/sciadv.aav0547. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Xu P., Xu J., Liu G., Chen L., Zhou Z., Peng W., Jiang Y., Zhao Z. , Цзя З., Сунь Ю. и др. Аллотетраплоидное происхождение и эволюция асимметричного генома карпа Cyprinus carpio . Нац. коммун. 2019;10:4625. doi: 10.1038/s41467-019-12644-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Session A.M., Uno Y., Kwon T., Chapman J.A., Toyoda A., Takahashi S., Fukui A., Hikosaka A., Suzuki A., Kondo M., et al. Эволюция генома аллотетраплоидной лягушки Xenopus laevis . Природа. 2016; 538: 336–343. doi: 10.1038/nature19840. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
11. Du K., Stöck M., Kneitz S., Klopp C., Woltering J.M., Adolfi M.C., Feron R., Prokopov D., Makunin А., Кичигин И. и др. Последовательность генома стерляди и механизмы сегментарной редиплоидизации. Нац. Экол. Эвол. 2020; 4: 841–852. дои: 10. 1038/s41559-020-1166-х. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1038/s41559-020-1166-х. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Бертло К., Брюне Ф., Чалопин Д., Хуанчич А., Бернар М., Ноэль Б., Бенто П., Да Силва С. ., Лабади К., Альберти А. и др. Геном радужной форели дает новое представление об эволюции после дупликации всего генома у позвоночных. Нац. коммун. 2014;5:3657. doi: 10.1038/ncomms4657. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
13. Флот Дж.-Ф., Хеспилс Б., Ли С., Ноэль Б., Архипова И., Данчин Э.Г.Дж., Хейнол А., Хенриссат Б., Кошул Р., Аури Ж.-М. и др. Геномные доказательства амеотической эволюции бделлоидной коловратки Адинета вага . Природа. 2013; 500:453–457. doi: 10.1038/nature12326. [PubMed] [CrossRef] [Google Scholar]
14. Schwager E.E., Sharma P.P., Clarke T., Leite D.J., Wierschin T., Pechmann M., Akiyama-Oda Y., Esposito L., Bechsgaard J., Bilde Т. и др. Геном домашнего паука обнаруживает древнюю дупликацию всего генома во время эволюции паукообразных. БМС Биол. 2017;15:62. doi: 10.1186/s12915-017-0399-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2017;15:62. doi: 10.1186/s12915-017-0399-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Нонг В., Цюй З., Ли Ю., Бартон-Оуэн Т., Вонг А.Ю.П., Ип Х.Ю., Ли Х.Т., Нараяна С., Барил Т., Суэйл Т. и др. Геномы мечехвоста раскрывают эволюционные судьбы генов и микроРНК после трех раундов (3R) дупликации всего генома. bioRxiv. 2020 г.: 10.1101/2020.04.16.045815. [Перекрестная ссылка] [Академия Google]
16. Lu J., Peatman E., Tang H., Lewis J., Liu Z. Профилирование паттернов дупликации генов в секвенированных геномах костистых костистых рыб: доказательства быстрого расширения генома, специфичного для линии, опосредованного недавними тандемными дупликациями. БМС Геном. 2012;13:246. дои: 10.1186/1471-2164-13-246. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Fernández R., Gabaldón T. Получение и потеря генов на многоклеточном древе жизни. Нац. Экол. Эвол. 2020; 4: 524–533. doi: 10.1038/s41559-019-1069-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Бартель Д.П. МикроРНК многоклеточных животных. Клетка. 2018; 173:20–51. doi: 10.1016/j.cell.2018.03.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Бартель Д.П. МикроРНК многоклеточных животных. Клетка. 2018; 173:20–51. doi: 10.1016/j.cell.2018.03.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
19. Озата Д.М., Гайнетдинов И., Зох А., О’Кэрролл Д., Заморе П.Д. PIWI-взаимодействующие РНК: малые РНК с большими функциями. Нац. Преподобный Жене. 2019;20:89–108. doi: 10.1038/s41576-018-0073-3. [PubMed] [CrossRef] [Google Scholar]
20. Гримсон А., Сривастава М., Фэйи Б., Вудкрофт Б.Дж., Чанг Х.Р., Кинг Н., Дегнан Б.М., Рохсар Д.С., Бартел Д.П. Раннее происхождение и эволюция микроРНК и Piwi-взаимодействующих РНК у животных. Природа. 2008;455:1193–1197. doi: 10.1038/nature07415. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Березиков Е. Эволюция разнообразия и регуляции микроРНК у животных. Нац. Преподобный Жене. 2011; 12:846–860. doi: 10.1038/nrg3079. [PubMed] [CrossRef] [Google Scholar]
22. Брате Дж., Нойманн Р.С., Фромм Б., Харальдсен А.А.Б., Тарвер Дж.Е., Суга Х., Донохью П. С.Дж., Петерсон К.Дж., Руис-Трилло И., Грини П.Е., и другие. Одноклеточное происхождение аппарата микроРНК животных. Курс. биол. 2018;28:3288–3295. doi: 10.1016/j.cub.2018.08.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
С.Дж., Петерсон К.Дж., Руис-Трилло И., Грини П.Е., и другие. Одноклеточное происхождение аппарата микроРНК животных. Курс. биол. 2018;28:3288–3295. doi: 10.1016/j.cub.2018.08.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Кернер П., Дегнан С.М., Маршан Л., Дегнан Б.М., Верворт М. Эволюция РНК-связывающих белков у животных: взгляд на весь геном Анализ в губке Amphimedon queenslandica . Мол. биол. Эволют. 2011;28:2289–2303. doi: 10.1093/molbev/msr046. [PubMed] [CrossRef] [Google Scholar]
24. Yi R. Exportin-5 опосредует ядерный экспорт пре-микроРНК и коротких шпилечных РНК. Гены Дев. 2003;17:3011–3016. doi: 10.1101/gad.1158803. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Бонсак М.Т. Exportin 5 представляет собой RanGTP-зависимый dsRNA-связывающий белок, который опосредует ядерный экспорт pre-miRNAs. РНК. 2004; 10: 185–191. doi: 10.1261/РНК.5167604. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Wang J., Lee J.E., Riemondy K., Yu Y., Marquez S.M., Lai E.C., Yi R. XPO5 способствует первичному процессингу микроРНК независимо от РанГТП. Нац. коммун. 2020;11:1845. doi: 10.1038/s41467-020-15598-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Wang J., Lee J.E., Riemondy K., Yu Y., Marquez S.M., Lai E.C., Yi R. XPO5 способствует первичному процессингу микроРНК независимо от РанГТП. Нац. коммун. 2020;11:1845. doi: 10.1038/s41467-020-15598-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Мартинес И., Хейс К.Е., Барр Дж.А., Гарольд А.Д., Се М., Бухари С.И.А., Васудеван С., Стейц Дж.А., ДиМайо Д. Путь биогенеза экспортин-1-зависимой микроРНК во время покоя клеток человека. проц. Натл. акад. науч. США. 2017;114:E4961–E4970. doi: 10.1073/pnas.1618732114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Ким Ю.-К., Ким Б., Ким В.Н. Переоценка роли DROSHA , Exportin 5 и DICER в биогенезе микроРНК. проц. Натл. акад. науч. США. 2016; 113:E1881–E1889. doi: 10.1073/pnas.1602532113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Мукерджи К., Кампос Х., Колачковски Б. Эволюция животных и растительных дайсеров: ранние параллельные дупликации и рекуррентная адаптация связывания противовирусной РНК в растениях.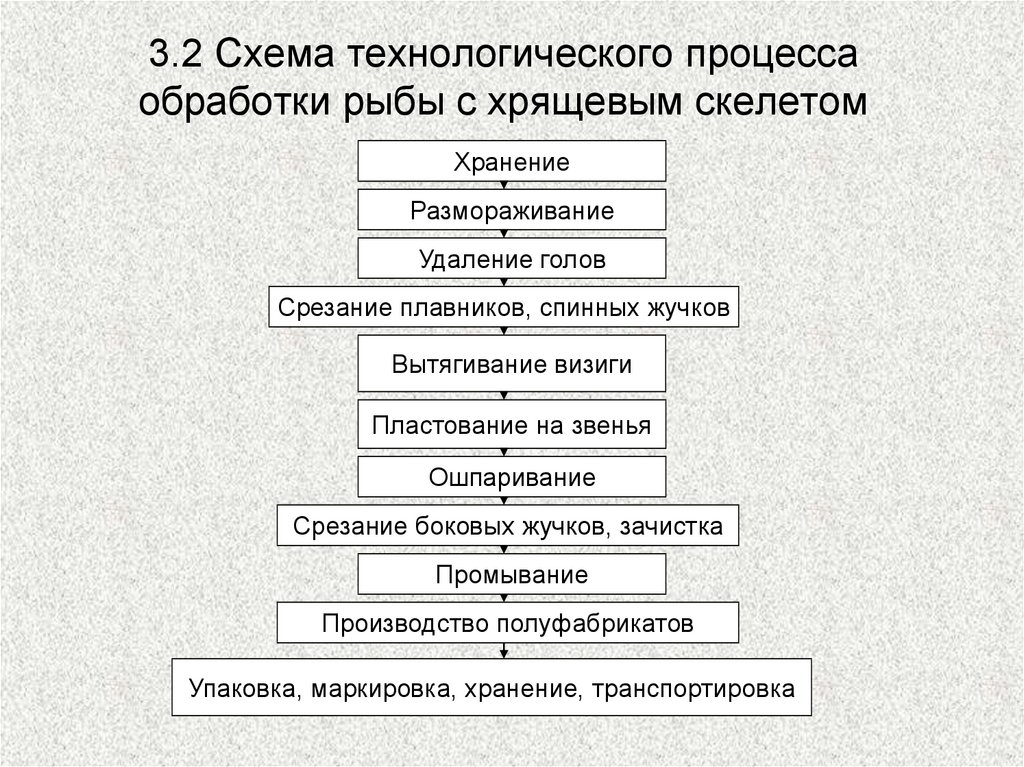 Мол. биол. Эвол. 2013;30:627–641. doi: 10.1093/molbev/mss263. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мол. биол. Эвол. 2013;30:627–641. doi: 10.1093/molbev/mss263. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Ахарони Р., Тоби Д. Динамическое сравнение Дроши и Дайсера показывает сходство и различие функциональных движений. ПЛОС ОДИН. 2019;14:e0226147. doi: 10.1371/journal.pone.0226147. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. De Jong D., Eitel M., Jakob W., Osigus H.-J., Hadrys H., DeSalle R., Schierwater B. Множественные генов Dicer у ранних дивергирующих Metazoa. Мол. биол. Эвол. 2009; 26:1333–1340. doi: 10.1093/molbev/msp042. [PubMed] [CrossRef] [Google Scholar]
32. Гао З., Ван М., Блэр Д., Чжэн Ю., Доу Ю. Филогенетический анализ семейства эндорибонуклеаз Dicer. ПЛОС ОДИН. 2014;9:e95350. doi: 10.1371/journal.pone.0095350. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
РНКи в почкующихся дрожжах. Наука. 2009; 326: 544–550. doi: 10.1126/science.1176945. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Kingsolver MB, Huang Z., Hardy RW Противовирусный врожденный иммунитет насекомых: пути, эффекторы и связи. Дж. Мол. биол. 2013; 425:4921–4936. doi: 10.1016/j.jmb.2013.10.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Kingsolver MB, Huang Z., Hardy RW Противовирусный врожденный иммунитет насекомых: пути, эффекторы и связи. Дж. Мол. биол. 2013; 425:4921–4936. doi: 10.1016/j.jmb.2013.10.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Gammon D.B., Mello C.C. Противовирусная защита насекомых, опосредованная РНК-интерференцией. Курс. мнение наук о насекомых. 2015;8:111–120. doi: 10.1016/j.cois.2015.01.006. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
36. Poirier E.Z., Goic B., Tomé-Poderti L., Frangeul L., Boussier J., Gausson V., Blanc H., Vallet T. ., Лойд Х., Леви Л.И. и соавт. Dicer-2-зависимая генерация вирусной ДНК из дефектных геномов РНК-вирусов модулирует противовирусный иммунитет у насекомых. Клеточный микроб-хозяин. 2018;23:353–365. doi: 10.1016/j.chom.2018.02.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Bouché N., Lauressergues D., Gasciolli V., Vaucheret H. Антагонистическая функция для Arabidopsis DCL2 в разработке и новая функция для DCL4 в создании вирусных миРНК. EMBO J. 2006; 25: 3347–3356. doi: 10.1038/sj.emboj.7601217. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
EMBO J. 2006; 25: 3347–3356. doi: 10.1038/sj.emboj.7601217. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Qin C., Li B., Fan Y., Zhang X., Yu Z., Ryabov E., Zhao M., Wang H. , Ши Н., Чжан П. и др. Роль Dicer-подобных белков 2 и 4 во внутри- и межклеточном антивирусном молчании. Завод Физиол. 2017; 174:1067–1081. doi: 10.1104/стр.17.00475. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Делерис А., Гальего-Бартоломе Дж., Бао Дж., Касшау К.Д., Кэррингтон Дж.К., Войннет О. Иерархическое действие и ингибирование растительных дицер-подобных белков в противовирусной защите. Наука. 2006; 313: 68–71. doi: 10.1126/science.1128214. [PubMed] [CrossRef] [Google Scholar]
40. Fukudome A., Fukuhara T. Растительные дайсероподобные белки: двухцепочечные РНК-расщепляющие ферменты для биогенеза малых РНК. Дж. Плант Рез. 2017;130:33–44. doi: 10.1007/s10265-016-0877-1. [PubMed] [CrossRef] [Академия Google]
41. Вайнант Н., Сантос Д., Ванден Брок Дж. Эволюция животных аргонавтов: доказательства отсутствия противовирусных аргонавтов AGO у позвоночных. науч. 2017;7:9230. doi: 10.1038/s41598-017-08043-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эволюция животных аргонавтов: доказательства отсутствия противовирусных аргонавтов AGO у позвоночных. науч. 2017;7:9230. doi: 10.1038/s41598-017-08043-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Hutvagner G., Simard MJ Argonaute, белки: ключевые игроки в подавлении РНК. Нац. Преподобный Мол. Клеточная биол. 2008; 9: 22–32. doi: 10.1038/nrm2321. [PubMed] [CrossRef] [Google Scholar]
43. Мейстер Г. Белки Argonaute: Функциональные идеи и новые роли. Нац. Преподобный Жене. 2013; 14:447–459. doi: 10.1038/nrg3462. [PubMed] [CrossRef] [Google Scholar]
44. Уолдрон Ф.М., Стоун Г.Н., Оббард Д.Дж. Метагеномное секвенирование предполагает разнообразие реакций, подобных РНК-интерференции, на вирусы у многоклеточных эукариот. Генетика PLoS. 2018;14:e1007533. doi: 10.1371/journal.pgen.1007533. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
45. McFarlane L., Svingen T., Braasch I., Koopman P., Schartl M., Wilhelm D. Расширение семейства генов Ago в кладе костистых. Дев. Гены Эвол. 2011;221:95–104. doi: 10.1007/s00427-011-0363-7. [PubMed] [CrossRef] [Google Scholar]
Дев. Гены Эвол. 2011;221:95–104. doi: 10.1007/s00427-011-0363-7. [PubMed] [CrossRef] [Google Scholar]
46. Bemis W.E., Findeis EK, Grande L. Обзор Acipenseriformes. В: Бирштейн В.Дж., Уолдман Дж.Р., Бемис В.Е., редакторы. Биоразнообразие и сохранение осетровых. Том 17. Издательство Kluwer Academic Publishers; Дордрехт, Нидерланды: 1997. стр. 25–71. (Развитие экологической биологии рыб). [Google Scholar]
47. Луо Д., Ли Ю., Чжао К., Чжао Л., Людвиг А., Пэн З. Филогенетические отношения с высоким разрешением внутри отряда осетровых согласно новым ядерным маркерам. Гены. 2019;10:38. doi: 10.3390/genes10010038. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Cheng P., Huang Y., Du H., Li C., Lv Y., Ruan R., Ye H., Bian C. , You X., Xu J. и др. Проект генома и полная характеристика Hox-кластера фронта стерляди ( Acipenser ruthenus ). Жене. 2019;10:776. doi: 10.3389/fgene.2019.00776. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Хрбек Т., Секингер Дж., Мейер А. Филогенетический и биогеографический взгляд на эволюцию пецилий. Мол. Филогенет. Эвол. 2007;43:986–998. doi: 10.1016/j.ympev.2006.06.009. [PubMed] [CrossRef] [Google Scholar]
Хрбек Т., Секингер Дж., Мейер А. Филогенетический и биогеографический взгляд на эволюцию пецилий. Мол. Филогенет. Эвол. 2007;43:986–998. doi: 10.1016/j.ympev.2006.06.009. [PubMed] [CrossRef] [Google Scholar]
50. Sankoff D., Zheng C., Wang B., Abad Najar C.F.B. Структурные и функциональные механизмы потери двойных генов после удвоения всего генома. БМК Биоинф. 2015;16:S9. doi: 10.1186/1471-2105-16-S17-S9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Zhou X., Guo H., Chen K., Cheng H., Zhou R. Идентификация, картирование хромосом и консервативная синтения свиней Argonaute семейство генов. Генетика. 2010; 138:805–812. doi: 10.1007/s10709-010-9462-z. [PubMed] [CrossRef] [Google Scholar]
52. Höck J., Meister G. Семейство белков Argonaute. Геном биол. 2008;9:210. doi: 10.1186/gb-2008-9-2-210. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Mendivil Ramos O., Ferrier D.E.K. Механизмы дублирования и транслокации генов и прогресс в понимании их относительного вклада в эволюцию генома животных. Междунар. Дж. Эвол. биол. 2012;2012:1–10. doi: 10.1155/2012/846421. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Междунар. Дж. Эвол. биол. 2012;2012:1–10. doi: 10.1155/2012/846421. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Вудс И.Г., Уилсон С., Фридлендер Б., Чанг П., Рейес Д.К., Никс Р., Келли П.Д., Чу Ф., Постлетвейт Дж.Х., Талбот В.С. Карта генов рыбок данио определяет хромосомы предков позвоночных. Геном Res. 2005; 15:1307–1314. doi: 10.1101/gr.4134305. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Нгуен Т.А., Джо М.Х., Чой Ю.-Г., Пак Дж., Квон С.К., Хон С., Ким В.Н., Ву Дж.- С. Функциональная анатомия человеческого микропроцессора. Клетка. 2015; 161:1374–1387. doi: 10.1016/j.cell.2015.05.010. [PubMed] [CrossRef] [Академия Google]
56. Квон С.К., Нгуен Т.А., Чой Ю.-Г., Джо М.Х., Хонг С., Ким В.Н., Ву Дж.-С. Структура ДРОША человека. Клетка. 2016; 164:81–90. doi: 10.1016/j.cell.2015.12.019. [PubMed] [CrossRef] [Google Scholar]
57. Tang X., Zhang Y., Tucker L., Ramratnam B. Фосфорилирование фермента РНКазы III Drosha по Serine300 или Serine302 необходимо для его ядерной локализации. Нуклеиновые Кислоты Res. 2010; 38:6610–6619. doi: 10.1093/nar/gkq547. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нуклеиновые Кислоты Res. 2010; 38:6610–6619. doi: 10.1093/nar/gkq547. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Tang X., Li M., Tucker L., Ramratnam B. Киназа гликогенсинтазы 3 бета (GSK3β) фосфорилирует фермент РНКазы III Drosha в S300 и S302. ПЛОС ОДИН. 2011;6:e20391. doi: 10.1371/journal.pone.0020391. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Tang X., Wen S., Zheng D., Tucker L., Cao L., Pantazatos D., Moss S.F., Ramratnam B. Ацетилирование дроши на N-конце ингибирует его деградацию за счет убиквитинирования. ПЛОС ОДИН. 2013;8:e72503. doi: 10.1371/journal.pone.0072503. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Yang Q., Li W., She H., Dou J., Duong D.M., Du Y., Yang S.-H., Seyfried N.T., Fu H., Gao G., et al. Стресс индуцирует p38 MAPK-опосредованное фосфорилирование и ингибирование Drosha-зависимого выживания клеток. Мол. Клетка. 2015;57:721–734. doi: 10.1016/j.molcel.2015.01.004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
61. Линк С., Грунд С.Е., Дидерихс С. Альтернативный сплайсинг влияет на субклеточную локализацию Дроши. Нуклеиновые Кислоты Res. 2016;44:5330–5343. дои: 10.1093/нар/gkw400. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Линк С., Грунд С.Е., Дидерихс С. Альтернативный сплайсинг влияет на субклеточную локализацию Дроши. Нуклеиновые Кислоты Res. 2016;44:5330–5343. дои: 10.1093/нар/gkw400. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Lee D., Shin C. Новые роли DROSHA помимо первичного процессинга микроРНК. РНК биол. 2018;15:186–193. doi: 10.1080/15476286.2017.1405210. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Chen G.R., Sive H., Bartel D.P. Несоответствие семян усиливает расщепление, катализируемое Argonaute2, и частично восстанавливает сильно нарушенное расщепление, обнаруженное у рыб. Мол. Клетка. 2017;68:1095–1107.e5. doi: 10.1016/j.molcel.2017.11.032. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Айзенберг Э., Леванон Э.Ю. Еще раз о генах домашнего хозяйства человека. Тенденции Жене. 2013; 29: 569–574. doi: 10.1016/j.tig.2013.05.010. [PubMed] [CrossRef] [Google Scholar]
65. Yang X., Yue H., Ye H., Shan X. , Xie X., Li C., Wei Q. Идентификация и характеристика двух генов piwi и их экспрессия в ответ на E2 (17β-эстрадиол) у осетра Дабри Acipenser dabryanus . Науки о рыбе. 2020; 86: 307–317. doi: 10.1007/s12562-019-01396-y. [Перекрестная ссылка] [Академия Google]
, Xie X., Li C., Wei Q. Идентификация и характеристика двух генов piwi и их экспрессия в ответ на E2 (17β-эстрадиол) у осетра Дабри Acipenser dabryanus . Науки о рыбе. 2020; 86: 307–317. doi: 10.1007/s12562-019-01396-y. [Перекрестная ссылка] [Академия Google]
66. МакГиннис С., Мэдден Т.Л. BLAST: в основе мощного и разнообразного набора инструментов анализа последовательности. Нуклеиновые Кислоты Res. 2004;32:W20–W25. doi: 10.1093/nar/gkh535. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Katoh K., Rozewicki J., Yamada K.D. Онлайн-сервис MAFFT: множественное выравнивание последовательностей, интерактивный выбор последовательности и визуализация. Краткий. биоинф. 2019;20:1160–1166. doi: 10.1093/bib/bbx108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Эдгар Р.К. MUSCLE: множественное выравнивание последовательностей с высокой точностью и высокой пропускной способностью. Нуклеиновые Кислоты Res. 2004; 32: 1792–1797. doi: 10.1093/nar/gkh440. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1093/nar/gkh440. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Лефорт В., Лонгвиль Ж.-Э., Гаскюэль О. SMS: Умный выбор модели в PhyML. Мол. биол. Эвол. 2017;34:2422–2424. doi: 10.1093/molbev/msx149. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Durand D., Halldórsson B.V., Vernot B. Гибридный микро-макроэволюционный подход к реконструкции генетического дерева. Дж. Вычисл. биол. 2006; 13:320–335. дои: 10.1089/смб.2006.13.320. [PubMed] [CrossRef] [Google Scholar]
71. Верно Б., Штольцер М., Гольдман А., Дюран Д. Примирение с деревьями небинарных видов. Дж. Вычисл. биол. 2008; 15: 981–1006. doi: 10.1089/cmb.2008.0092. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Stolzer M., Lai H., Xu M., Sathaye D., Vernot B., Durand D. Вывод дублирования, потери, передачи и неполного сортировка по происхождению с деревьями небинарных видов. Биоинформатика. 2012; 28: i409–i415. дои: 10.1093/биоинформатика/bts386. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
[PMC free article] [PubMed] [CrossRef] [Google Scholar]
73. Guindon S., Dufayard J.-F., Lefort V., Anisimova M., Hordijk W., Gascuel O. New Algorithms and Methods to Оценка филогений максимального правдоподобия: оценка производительности PhyML 3.0. Сист. биол. 2010;59:307–321. doi: 10.1093/sysbio/syq010. [PubMed] [CrossRef] [Google Scholar]
74. Кумар С., Стечер Г., Ли М., Князь К., Тамура К. MEGA X: Молекулярно-эволюционный генетический анализ на вычислительных платформах. Мол. биол. Эвол. 2018; 35:1547–1549. doi: 10.1093/molbev/msy096. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Хьюсон Д.Х., Скорнавакка К. Дендроскоп 3: Интерактивный инструмент для укорененных филогенетических деревьев и сетей. Сист. биол. 2012;61:1061–1067. doi: 10.1093/sysbio/sys062. [PubMed] [CrossRef] [Google Scholar]
76. Летуник И., Борк П. Интерактивное Древо Жизни (iTOL) v4: Последние обновления и новые разработки. Нуклеиновые Кислоты Res. 2019;47:W256–W259. doi: 10.1093/nar/gkz239. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1093/nar/gkz239. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Гай Л., Роат Культима Дж., Андерссон С.Г.Е. genoPlotR: Сравнительная визуализация генов и геномов в R. Биоинформатика. 2010;26:2334–2335. doi: 10.1093/биоинформатика/btq413. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Chen S., Zhou Y., Chen Y., Gu J. fastp: сверхбыстрый универсальный препроцессор FASTQ. Биоинформатика. 2018;34:i884–i890. doi: 10.1093/биоинформатика/bty560. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Kim D., Paggi J.M., Park C., Bennett C., Salzberg S.L. Выравнивание генома на основе графа и генотипирование с помощью HISAT2 и HISAT-генотипа. Нац. Биотехнолог. 2019;37:907–915. doi: 10.1038/s41587-019-0201-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Li H., Handsaker B., Wysoker A., Fennell T., Ruan J., Homer N., Marth G., Abecasis G. , Дурбин Р. Подгруппа обработки данных проекта 1000 Genome Формат Sequence Alignment/Map и SAMtools. Биоинформатика. 2009;25:2078–2079. doi: 10.1093/биоинформатика/btp352. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Биоинформатика. 2009;25:2078–2079. doi: 10.1093/биоинформатика/btp352. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Pertea M., Pertea G.M., Antonescu C.M., Chang T.-C., Mendell J.T., Salzberg S.L. StringTie обеспечивает улучшенную реконструкцию транскриптома из чтений РНК-seq. Нац. Биотехнолог. 2015;33:290–295. doi: 10.1038/nbt.3122. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Куинлан А.Р., Холл И.М. BEDTools: гибкий набор утилит для сравнения геномных признаков. Биоинформатика. 2010; 26:841–842. doi: 10.1093/биоинформатика/btq033. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Технологические сосуды с нижним приводом — Terlet — Каталоги в формате PDF | Техническая документация
Добавить в избранное
{{requestButtons}}
Выдержки из каталога
стерлядь Технологические сосуды с нижним приводом
Технологические сосуды с нижним приводом Варочные котлы и охладители TERLET с мешалками с нижним приводом используются для всех видов пищевых продуктов с высокой вязкостью, таких как супы/соусы, готовые блюда и т.