Содержание
Расшифрован геном царь-рыбы – Наука – Коммерсантъ
Осетровые рыбы имеют древнейшее происхождение и не относятся к более привычным нам костистым рыбам. Недавно в журнале Nature Ecology Evolution появилась статья международной группы биологов (Россия, Германия, США, Франция и Швейцария), которой удалось качественно расшифровать и собрать геном стерляди. В мире есть несколько научных коллективов, работающих по этой теме, но это первый случай расшифровки генома осетровых, поскольку он сложно поддается изучению из-за полиплоидности. Этот способ эволюции геномов часто встречается у растений, но довольно редок у животных, хотя даже у рыбоподобных предков человека было два раунда удвоения геномов.
Владимир Трифонов, заведующий лабораторией сравнительной геномики Института молекулярной и клеточной биологии Сибирского отделения РАН, доктор биологических наук Работа поддержана грантом Российского научного фонда для совместных российско-немецких проектов
Фото: Из личного архива
Владимир Трифонов, заведующий лабораторией сравнительной геномики Института молекулярной и клеточной биологии Сибирского отделения РАН, доктор биологических наук Работа поддержана грантом Российского научного фонда для совместных российско-немецких проектов
Фото: Из личного архива
Владимир Трифонов, заведующий лабораторией сравнительной геномики Института молекулярной и клеточной биологии Сибирского отделения РАН, доктор биологических наук Работа поддержана грантом Российского научного фонда для совместных российско-немецких проектов.
Мы все помним из школы, что от папы и от мамы мы получаем по одному набору генов. Среди них есть, допустим, доминантный и рецессивный варианты гена, и можно составить карту генома и проследить, какие варианты откуда взялись. Генетика хорошо разработана для диплоидных видов, к которым относится большинство модельных организмов, включая человека. Геномы человека и других млекопитающих, рептилий и птиц сейчас собираются достаточно просто.
Но у осетровых геном в процессе эволюции удваивался, причем у некоторых видов — неоднократно, поэтому составить его карту очень непросто. Если для расшифровки, а точнее, для последующего составления карты генома диплоидных видов существуют специальные программы и протоколы, то здесь такого отработанного механизма еще нет. Нужно было модифицировать программы, которые бы могли распознавать не только аллели, но и паралоги генов, произошедшие в результате дупликации генома. Параллельно с нами работа ведется в нескольких других научных центрах — у конкурирующих научных групп в Кембридже (Великобритания) и знаменитом теперь Ухане (Китай). Каждая из научных групп пыталась найти свой подход к решению задач по расшифровке генома осетровых с разной степенью успешности.
Каждая из научных групп пыталась найти свой подход к решению задач по расшифровке генома осетровых с разной степенью успешности.
Задачи по сборке полиплоидных геномов во всем мире решаются всего около пяти-десяти лет, и сегодня в разных лабораториях только начали появляться решения и механизмы, позволяющие работать с полиплоидами, к которым кроме осетровых относятся лососевые, карп, золотая рыбка и некоторые другие виды. Первые исследования, конечно, пока не дают настолько хорошо собранных геномов, как для диплоидных организмов. Поэтому в этой области каждый полученный и многократно выверенный результат — это большой шаг. Мы выбрали своим объектом именно геном стерляди, поскольку он меньше по размеру, чем у многих других осетровых, например, у сибирского осетра. У стерляди произошло только одно удвоение, тогда как у русского, сибирского и китайского осетров был еще один дополнительный раунд удвоения. Именно по этой причине у китайских коллег, довольно давно приступивших к анализу генома китайского осетра, до сборки полного генома дело пока не дошло, хотя им удалось его расшифровать, и они активно занимаются этой темой более 15 лет.
Для какой цели эволюция «использовала» полиплоидизацию? Конечно, для инноваций! Дело в том, что при наличии только двух копий каждого гена, как у диплоидов, гены эволюционируют постепенно, любые кардинальные эксперименты эволюции — это огромный риск. А при наличии дополнительных копий, возникших после удвоения генома, эволюция может свободно ставить любые эксперименты, будучи подстрахованной уже имеющимися неизменными вариантами.
В отличие от диплоидного варианта сборки, мы решали прямую задачу — механически непосредственно вырезали хромосомы, секвенировали их и исследовали последовательности нуклеотидов ДНК на каждой из копий. Обычно при секвенировании диплоидов задача обратная — из уже собранного набора данных выделяют и изучают отдельные хромосомы.
Интересно, что после удвоения генома в ходе эволюции обычно начинаются процессы сокращения, причем у стерляди некоторые участки генома становились диплоидными, то есть имели всего два набора, а некоторые так и оставались полиплоидными. Были и процессы дополнительных генных дупликаций, особенно много удвоений у стерляди происходило с участием гена рецепторов глутаминовой кислоты, связанного с умственной деятельностью. Некоторые процессы, связанные с формированием стратегии поведения, определяются работой этого гена. Может быть, этот факт вызовет у этологов интерес к изучению поведения осетровых, и мы узнаем о них что-то новое и удивительное.
Были и процессы дополнительных генных дупликаций, особенно много удвоений у стерляди происходило с участием гена рецепторов глутаминовой кислоты, связанного с умственной деятельностью. Некоторые процессы, связанные с формированием стратегии поведения, определяются работой этого гена. Может быть, этот факт вызовет у этологов интерес к изучению поведения осетровых, и мы узнаем о них что-то новое и удивительное.
Эволюция осетровых происходила крайне медленно по сравнению даже с костистыми рыбами.
Другие виды рыб постоянно приспосабливались к условиям и формировали новые морфологические варианты, а осетровые за 400 млн лет жизни внешне очень мало изменились. Удвоение генома стерляди произошло еще во времена динозавров — в юрском периоде. Между собой разные виды осетровых тоже мало отличаются — даже специалист иногда не может разобраться в молодых особях осетровых. Малые отличия позволяют разным видам осетровых скрещиваться, образуя гибриды. Так, в СССР был выведен бестер — гибрид, полученный скрещиванием огромной белуги и небольшой стерляди.
Если поискать аналогию подобных «живых ископаемых» среди высших позвоночных животных, то можно сравнить их с гаттерией, которая тоже сохранила много архаичных признаков, несмотря на изменявшиеся условия. Осетровые не только сохранили много древнейших архаичных черт, но и их геном эволюционировал также удивительно медленно. Осетровые уже не одно десятилетие находятся под угрозой вымирания. Ключевую роль в резком сокращении популяции и видов осетровых сыграли миграции — многие осетры зимуют в устьях рек или в океане и проходят на нерест сотни километров, а с появлением на реках плотин это стало невозможным. Стерлядь, к нашей радости,— это оседлый вид, который не нуждается в больших миграциях. Захочет ли местная стерлядь жить в других сибирских реках, где она не водилась ранее,— это еще один вопрос, на который поможет ответить ее геном. И таких вопросов очень много. Без детального исследования генома все эксперименты по скрещиванию видов или разведению рыб в новых условиях это потеря времени и денег.
Из 25 современных видов осетровых 11 встречаются в России. В сибирских реках, впадающих в Северный Ледовитый океан, водятся только сибирский осетр и стерлядь. А в Волге кроме стерляди водятся русский осетр, шип, белуга, севрюга, иранский осетр. На Дальнем Востоке водятся амурский осетр, сахалинский осетр и калуга. Правда, строительство плотин на реках очень сильно сократило их популяцию и видовое разнообразие, поэтому в 1960-е годы в СССР начали строить закрытые искусственные системы для сохранения и разведения осетровых. Позже эту инициативу подхватили и другие страны. Осетров, которых мы можем сегодня видеть в магазинах, выращивают именно в таких водоемах.
Сохранение видового разнообразия очень важно для современной биологии. Для этого можно использовать методы повышения экономической целесообразности искусственного разведения видов. Если мы, генетики, допустим, хотим вывести породу осетровых, где большинство потомства будут составлять самки с ускоренным ростом и развитием, то такая порода будет нужна для производства черной икры. А за рубежом разводят часто именно сибирского осетра, которого в советское время наша страна активно экспортировала. Чтобы сохранить разные виды, нужно разводить мальков и выпускать в естественную среду, а для этого необходимо знать генетические особенности разных популяций.
А за рубежом разводят часто именно сибирского осетра, которого в советское время наша страна активно экспортировала. Чтобы сохранить разные виды, нужно разводить мальков и выпускать в естественную среду, а для этого необходимо знать генетические особенности разных популяций.
Основная цель массового разведения осетровых — это продажа черной икры, которая стоит около $10 тыс. за килограмм. Такая цена делает генетические исследования осетровых экономически оправданными. Но чтобы выявить участки генома, отвечающие за пол, генетической науке предстоит сделать еще много работы.
Nothing found for Len Fish Osetry
Добро пожаловать на сайт газеты для рыбаков и рыболовов!
Приветствуем Вас на территории вечного клёва – газеты «Питерский рыбак»
Ловись рыбка, большая и маленькая…
Среди бессмертных тем для мужского разговора, рыбалка занимает одну из первых позиций. Такой вид отдыха как рыбная ловля, доступен в круглогодичном режиме, поэтому заядлых рыболовов можно встретить за любимым занятием и знойным летом, и снежной зимой. Наверное, поклонников зимней рыбалки ничуть не меньше, чем любителей закинуть удочку в тёплые дни.
Наверное, поклонников зимней рыбалки ничуть не меньше, чем любителей закинуть удочку в тёплые дни.
Опытный рыболов всегда знает, когда лучше клёв и какие виды приманок наиболее эффективны. Любой рыболов вам скажет, что рыбалка всегда непредсказуема, ведь никогда не знаешь, чем закончится сегодняшняя рыбалка. Настоящий рыболов всегда готовится к рыбалке заранее: изучает календарь клёва, выбирает приманку и место ловли, подготавливает снасти. Зимняя рыбалка – лишнее тому подтверждение.
«Питерского рыбака видно из далека…»
Где же начинающему рыболову можно познакомиться со всеми хитростями этого вида отдыха, а опытному рыбаку – поделиться своими советами с товарищами? Читайте нашу интернет-газету и будьте в курсе всего, что происходит в мире рыболовства!
На нашем сайте вы найдёте исчерпывающую информацию о таком популярном виде активного отдыха как рыбалка. Здесь каждый начинающий рыболов сможет набраться необходимых знаний для продуктивной рыбалки, а опытные «охотники» всегда смогут узнать для себя что-то новое.
Мы уверенны, что «Питерский рыбак» станет вашей «настольной книгой» рыболова. Здесь вы сможете не только получить информацию о любимом виде отдыха, но и пообщаться с единомышленниками. Если вы хотите поделиться своими хитростями ловли рыбы или какой-то новостью, пожалуйста, присылайте нам и мы обязательно разместим ваш материал на сайте.
Всё о ловле рыбы на одном сайте
В нашей виртуальной газете Вы сможете прочитать о самых популярных местах клёва, о том, чем так хороша зимняя рыбалка, о видах рыб и их особенностях, а также о том, какое рыболовное снаряжение лучше взять с собой сегодня. Кроме того, здесь вы узнаете, какие мероприятия просто обязан посетить настоящий рыбак и какое блюдо лучше всего приготовить из богатого улова. Делитесь своим опытом в соцсетях, комментируйте рыболовные подвиги друг друга.
С нашей помощью рыбалка станет для вас ещё более интересным занятием!
В Бурятии завершена «Байкальская рыбалка»
24
Апр 2018
В Бурятии подошел к концу фестиваль под названием «Байкальская рыбалка», который традиционно собрал большое количество рыбаков.
Рубрика: МЕРОПРИЯТИЯ
Метки: №21 от 2017.03.16
Ваш отзыв
В Орловской области принимаются меры по ограничению рыбалки
23
Апр 2017
В Орловской области принимается решение по поводу ограничения рыболовного промысла.
Рубрика: РЫБОЛОВЛЯ
Метки: №21 от 2017.03.16
Ваш отзыв
На Байкале состоялись соревнования по рыбалке среди школьников
04
Апр 2017
На Байкале состоялось мероприятие по подледной рыбалке среди школьников.
Рубрика: МЕРОПРИЯТИЯ
Метки: №21 от 2017.03.16
Ваш отзыв
На Камчатке открыт сезон любительской рыбалки
03
Апр 2017
В камчатском регионе нашей страны стартовал сезон любительской рыбалки.
Рубрика: РЫБОЛОВЛЯ
Метки: №21 от 2017.03.16
Ваш отзыв
В Томске проводится фестиваль «Народная рыбалка»
18
Мар 2017
Сегодня в городе Томске стартовало мероприятие для настоящих рыбаков.
Рубрика: МЕРОПРИЯТИЯ
Метки: №21 от 2017.03.16
Ваш отзыв
О рыбалке в Пашозере, пригороде Санкт-Петербурга
16
Мар 2017
В пригородах Санкт-Петербурга расположено много водоемов. Многие из них являются идеальными для рыбалки. Платные водоемы отличают асфальтированные подъезды, стоянки для автотранспорта, очищенные от кустов берега, построенные мостки, лодки на прокат, возможность крупного улова.
Рубрика: МЕСТА
Метки: №21 от 2017.03.16
Один отзыв
В прошлом году импорт рыбной продукции упал на 9 процентов
04
Фев 2017
По итогам за весь прошлогодний период из нашей страны в другие государства мира было экспортировано на 6 процентов больше рыбной продукции.
Рубрика: РЫБОЛОВЛЯ
Метки: №19 от 2015.09.28
Ваш отзыв
На Сахалине стартовал сезон зимней рыбалки
30
Ноя 2016
На озере Малое Буссе Корсаковского района уже появился лед, что позволило многочисленным поклонникам рыбалки приехать сюда.
Рубрика: РЫБОЛОВЛЯ
Метки: №19 от 2015.04.18
Ваш отзыв
Ученые выяснили, что рыбалка продлевает жизнь
18
Ноя 2016
Исследователи провели очередной научный эксперимент, чтобы доказать пользу рыбалки или же опровергнуть этот миф.
Рубрика: РЫБОЛОВЛЯ
Метки: №1 от 2013.02.01
Ваш отзыв
На рынке рыба российского производства успешно заменяет импортную
28
Сен 2016
За последние 8 месяцев объемы ввоза импортной рыбы на территорию нашей страны сократились на 13 процентов.
Рубрика: РЫБЫ
Метки: №20 от 2016.02.02
Ваш отзыв
В Ингушетии прошла «Большая рыбалка», на которой были выявлены лучшие рыбаки
21
Сен 2016
В конце прошлого месяца в Ингушетии в городе Карабулак прошли соревнования по спортивному рыболовству.
Рубрика: МЕРОПРИЯТИЯ
Метки: №20 от 2016. 02.02
02.02
Ваш отзыв
Характеристика показателей подвижности спермиев сибирского осетра и стерляди в сравнении с данными CASA Научная научная статья по теме «Животноводство и молочное дело»
Арх. пол. Рыбы. (2012) 20: 137-143 DOI 10.2478/v10086-012-0016-0
ИССЛЕДОВАТЕЛЬСКАЯ СТАТЬЯ
Характеристика параметров подвижности сперматозоидов сибирского осетра и стерляди в сравнении с использованием CASA
Получено — 30 января 2012 г. Опубликовано в сети: 30 июня 2012 г.; ©Институт внутреннего рыболовства в Ольштыне, Польша. Цитирование: Сечинский П., Глоговски Й., Цейко Б.И., Григорук С. 2012 — Характеристики параметров подвижности спермиев сибирского осетра и стерляди в сравнении с использованием CASA — Arch. пол. Рыбы. 20: 137-143
Петр Сечинский, Ян Глоговски, Беата И. Цейко, Цезарий Григорук
Аннотация. Для оценки и сравнения параметров подвижности сперматозоидов сибирского осетра Acipenser baerii Brandt (n=15) и стерляди Acipenser ruthenus L.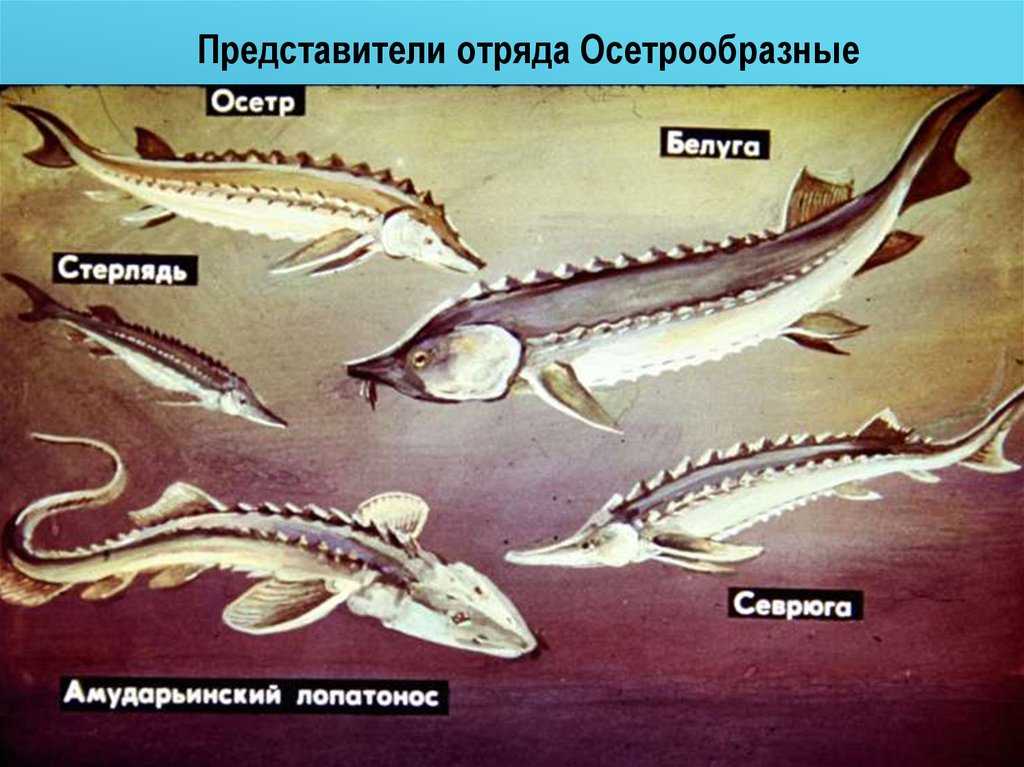 (n=15) использовали компьютерный анализ спермы (CASA). Анализ показал более высокий процент подвижной спермы (МОС) в сперме стерляди (44,8 %), чем в сперме сибирского осетра (41,3 %). Сперматозоиды двух исследованных видов были сходны по скорости, также было отмечено сходство по средней скорости пути VAP (9м с-1). Использование системы CASA позволило провести точную оценку подвижности сперматозоидов двух исследованных видов рыб и, таким образом, также позволило определить потенциальную пригодность спермы для использования в воспроизводстве осетровых.
(n=15) использовали компьютерный анализ спермы (CASA). Анализ показал более высокий процент подвижной спермы (МОС) в сперме стерляди (44,8 %), чем в сперме сибирского осетра (41,3 %). Сперматозоиды двух исследованных видов были сходны по скорости, также было отмечено сходство по средней скорости пути VAP (9м с-1). Использование системы CASA позволило провести точную оценку подвижности сперматозоидов двух исследованных видов рыб и, таким образом, также позволило определить потенциальную пригодность спермы для использования в воспроизводстве осетровых.
P. Sieczynski
Центр лечения бесплодия Kriobank, Белосток, Польша J. Glogowski
Кафедра ихтиологии, Факультет наук об окружающей среде и рыболовства, Варминьско-Мазурский университет, Ольштын, Польша Кафедра биологии гамет и эмбрионов Институт репродукции животных и пищевых исследований Польской академии наук, Ольштын, Польша
Б.И. Cejko [H]
Отделение биологии гамет и эмбрионов
Институт репродукции животных и пищевых исследований
Польская академия наук
ul.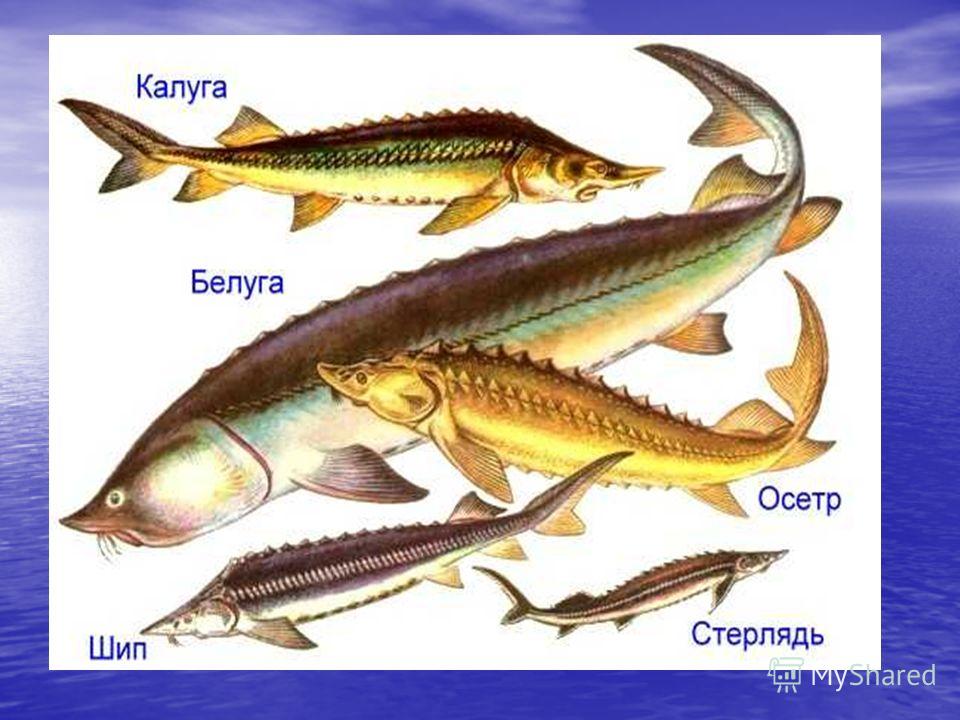 Быдгоска 7,10-243 Ольштын, Польша
Быдгоска 7,10-243 Ольштын, Польша
Тел. +48 89 539 31 33; e-mail: [email protected]
C. Grygoruk
Центр репродуктивной медицины Bocian, Белосток, Польша
Ключевые слова: Acipenser baerii, Acipenser ruthenus, сперматозоиды, CASA, подвижность, скорость
Введение
Вопросы качества гамет особенно важны при изучении репродуктивной биологии. Оценка их биологического качества имеет важное значение, особенно в отношении программ выращивания коммерчески важных видов, таких как карп, Cyprinis carpio L., радужная форель, Oncorhynchus mykiss Walbaum и виды осетровых. Почти все виды осетровых в настоящее время находятся под угрозой исчезновения, и многие из них имеют очень ограниченные ареалы обитания (Williot et al. 1997). Осетровые рыбы являются важным элементом поддержания биологического равновесия в водных системах. Они становятся объектами рыболовства из-за вкусного мяса и особенно ценятся за яйца, которые используются для производства икры (Гундерсен и Пирсон 19). 92, Мимс и Шелтон, 1998). Искусственное воспроизводство этих рыб и их выращивание в контролируемых условиях может быть успешным методом предотвращения вымирания популяций.
92, Мимс и Шелтон, 1998). Искусственное воспроизводство этих рыб и их выращивание в контролируемых условиях может быть успешным методом предотвращения вымирания популяций.
Наиболее важным аспектом репродуктивной биологии самцов является качество молока, которое включает способность сперматозоидов оплодотворять яйцеклетки. Таким образом, неоднократно подтверждались положительные, значимые корреляции между подвижностью сперматозоидов и процентом оплодотворенных
яйцеклеток (Moccia and Munkittrick 19).87), а процент подвижной спермы является одним из основных показателей, используемых для определения качества молока. До 1990-х годов подвижность сперматозоидов оценивали субъективно под световым микроскопом. По мере развития компьютерных технологий системы компьютерного анализа спермы (CASA) стали использоваться для анализа подвижности сперматозоидов (Kime et al., 1996, Ravinder et al., 1997, Dietrich et al., 2005). CASA был признан международными экспертными органами как надежный исследовательский и диагностический инструмент для определения фертильности мужских гамет (Эшре 1998). Примеры эффективного применения CASA включают исследования Kime and Tveiten (2002), которые использовали его для оценки свежей спермы пятнистой зубатки Anarhichas minor Olafsen. Они пришли к выводу, что из 14 параметров, измеренных с помощью системы CASA, шесть наиболее уязвимых к изменениям pH и осмоляльности активирующей жидкости в течение периода активности сперматозоидов: криволинейная скорость (VCL), прямолинейная скорость (VSL), средняя скорость пути. (VAP), перекрестная частота биений (BCF), амплитуда бокового смещения головки (ALH) и процент подвижных сперматозоидов (MOT). Следовательно, этот метод можно считать наиболее полезным для оценки подвижности сперматозоидов. Остальные параметры имели низкую диагностическую ценность. Использование CASA в токсикологических исследованиях, таких как исследования влияния ксенобиотиков или тяжелых металлов на параметры подвижности коммерчески важных видов рыб, свидетельствует о широком спектре его применения (Cosson et al. 2000, Dietrich et al.
Примеры эффективного применения CASA включают исследования Kime and Tveiten (2002), которые использовали его для оценки свежей спермы пятнистой зубатки Anarhichas minor Olafsen. Они пришли к выводу, что из 14 параметров, измеренных с помощью системы CASA, шесть наиболее уязвимых к изменениям pH и осмоляльности активирующей жидкости в течение периода активности сперматозоидов: криволинейная скорость (VCL), прямолинейная скорость (VSL), средняя скорость пути. (VAP), перекрестная частота биений (BCF), амплитуда бокового смещения головки (ALH) и процент подвижных сперматозоидов (MOT). Следовательно, этот метод можно считать наиболее полезным для оценки подвижности сперматозоидов. Остальные параметры имели низкую диагностическую ценность. Использование CASA в токсикологических исследованиях, таких как исследования влияния ксенобиотиков или тяжелых металлов на параметры подвижности коммерчески важных видов рыб, свидетельствует о широком спектре его применения (Cosson et al. 2000, Dietrich et al. 2010, Ярмолович и др., 2010).
2010, Ярмолович и др., 2010).
Многие исследования, посвященные подвижности сперматозоидов у других видов рыб и высших позвоночных (млекопитающих), доказали, что существует значительная положительная корреляция между значениями параметров CASA и частотой оплодотворения (Gage et al. 2004). Демонстрация такой сильной взаимозависимости у осетровых позволит прогнозировать успех оплодотворения без необходимости проведения дорогостоящих и долгосрочных биологических испытаний. Очень мало исследований в литературе посвящено применению CASA для осетровых рыб, и большинство из них относится к его использованию для оценки качества молока после заморозки (Ciereszko et al. 19).96, Глоговски и др. 2002). Цель настоящего исследования заключалась в оценке и сравнении параметров подвижности сперматозоидов в свежей
сперме сибирского осетра Acipenser baerii Brandt и стерляди Acipenser ruthenus L. с использованием компьютерного анализа спермы (CASA).
Материалы и методы Происхождение самцов
Молоко получено от самцов в декабре и январе из двух доступных источников: Отдела осетрового рыбоводства в Печарках, Института внутреннего рыболовства в Ольштыне и Экспериментального центра Отдела общей зоологии, Университет Щецина, где разводят рыбу в сточных водах Нижнеодерской электростанции. Самцы сибирского осетра из Дгала имели возраст 7+, живую массу 7-10,5 кг и общую длину (TL) около 110 см, а самцы стерляди были в возрасте 2-3 лет с живой массой 0,39-1,25 кг и общей длиной примерно 47-60 см. Самцов сибирского осетра выращивали от оплодотворения и содержали в резервуарах, входивших в состав замкнутой оборотной системы, в течение трех лет, после чего их переводили в земляные пруды. В декабре, за две недели до стимуляции, оба вида осетровых были переведены в бассейны с терморегуляцией и контролируемыми параметрами среды. Температуру воды за это время постепенно повышали с 7 до 12°С. Самцы сибирского осетра из Нижнеодерского центра были в возрасте 3+ лет, с массой тела 3-3,5 кг и общей длиной TL примерно 60-65 см; однако данных о самцах стерляди нет. Известно только, что самцы стерляди были в возрасте от 2+ до 5+ лет. Оба вида осетровых выращивались до января в пруду, расположенном в теплых водах канала при температуре 17°С.
Самцы сибирского осетра из Дгала имели возраст 7+, живую массу 7-10,5 кг и общую длину (TL) около 110 см, а самцы стерляди были в возрасте 2-3 лет с живой массой 0,39-1,25 кг и общей длиной примерно 47-60 см. Самцов сибирского осетра выращивали от оплодотворения и содержали в резервуарах, входивших в состав замкнутой оборотной системы, в течение трех лет, после чего их переводили в земляные пруды. В декабре, за две недели до стимуляции, оба вида осетровых были переведены в бассейны с терморегуляцией и контролируемыми параметрами среды. Температуру воды за это время постепенно повышали с 7 до 12°С. Самцы сибирского осетра из Нижнеодерского центра были в возрасте 3+ лет, с массой тела 3-3,5 кг и общей длиной TL примерно 60-65 см; однако данных о самцах стерляди нет. Известно только, что самцы стерляди были в возрасте от 2+ до 5+ лет. Оба вида осетровых выращивались до января в пруду, расположенном в теплых водах канала при температуре 17°С.
Гормональная стимуляция и манипуляции с производителями
Самцов сибирского осетра и стерляди из ЛРЗ «Дгал» гормонально стимулировали однократным внутрибрюшинным введением гипофиза осетра в дозе 2 мг/кг массы тела, а рыб из экспериментального центра
на Нижней Одере вводили Овопел [(D-Ala6, Pro9NEt) — mGnRH + метоклопрамид] в дозе 1 гранула кг 1 м. к. Одна гранула Овопела содержит 18–20 пг аналога гонадолиберина млекопитающих и 8–10 мг метоклопрамида (Horvath et al. 19).97). Состояние половозрелости самцов оценивали по их внешним признакам, таким как нерестовая сыпь на голове и внешний вид полового сосочка. Через 24 часа после гормональной стимуляции самцов анестезировали 0,2% раствором прописцина в 28 мл л воды. Затем молоко собирали с помощью катетера диаметром 4 мм, снабженного шприцем на 50 мл (Kolman et al., 1998). Молоки от отдельных самцов собирали в стерильные контейнеры и затем помещали на лед (2-4°С). После сбора сперма доставлялась в лабораторию, где ее анализировали в течение 20 минут. Общий объем молок, полученных от сибирского осетра, составил 73 ± 58 мл при концентрации 0,58 ± 0,37 млд мл1, а от стерляди 18 ± 13 мл и 0,46 ± 0,25 млд мл1 соответственно.
к. Одна гранула Овопела содержит 18–20 пг аналога гонадолиберина млекопитающих и 8–10 мг метоклопрамида (Horvath et al. 19).97). Состояние половозрелости самцов оценивали по их внешним признакам, таким как нерестовая сыпь на голове и внешний вид полового сосочка. Через 24 часа после гормональной стимуляции самцов анестезировали 0,2% раствором прописцина в 28 мл л воды. Затем молоко собирали с помощью катетера диаметром 4 мм, снабженного шприцем на 50 мл (Kolman et al., 1998). Молоки от отдельных самцов собирали в стерильные контейнеры и затем помещали на лед (2-4°С). После сбора сперма доставлялась в лабораторию, где ее анализировали в течение 20 минут. Общий объем молок, полученных от сибирского осетра, составил 73 ± 58 мл при концентрации 0,58 ± 0,37 млд мл1, а от стерляди 18 ± 13 мл и 0,46 ± 0,25 млд мл1 соответственно.
Оценка подвижности спермиев сибирского осетра и стерляди после сбора и до активации
Перед активацией спермы образцы молок проверяли на отсутствие загрязнения мочой при сборе. Метод субъективной световой микроскопии при увеличении в 400 раз использовали для оценки подвижности сперматозоидов перед активацией. Одну мкл неактивированной сыворотки помещали на предметное стекло и количество подвижных сперматозоидов оценивали с точностью до ± 1%.
Метод субъективной световой микроскопии при увеличении в 400 раз использовали для оценки подвижности сперматозоидов перед активацией. Одну мкл неактивированной сыворотки помещали на предметное стекло и количество подвижных сперматозоидов оценивали с точностью до ± 1%.
Оценка параметров подвижности сперматозоидов сибирского осетра и стерляди, определенных с помощью CASA
Отдельные параметры подвижности сперматозоидов сибирского осетра и стерляди определяли с помощью компьютеризированного прибора Hobson Sperm Tracker (HST) (Sence & Vision Electronic System Ltd., Шеффилд, Великобритания). Для нужд исследования и для распознавания HST спермы осетра
использовались следующие настройки: Пороги + 13/-12; Коэффициенты фильтрации 1:2; Коэффициенты фильтрации 2:2; Коэффициенты фильтрации 3:0; Коэффициенты фильтрации 4:0. Время анализа было установлено на 30 секунд. При анализе подвижности сперматозоидов температуру окружающей среды снижали до 15°С, а сперму выдерживали на льду (2-4°С). Температура столика микроскопа, на котором проводились испытания, составляла около 15°С. Подвижность сперматозоидов активировали буфером Янихена в соотношении 1:25 (100 мкл молока смешивают с 2500 мкл активирующей жидкости), состоящим из 10 мМ трис-HCl, 20 мМ NaCl, 2 мМ CaCl2 и pH 8,5 (Jahnichen et al. 1999), и препарат перемешивали как можно быстрее. Измерения проводились примерно через 5-10 секунд после начала подвижности сперматозоидов. Анализы проводились на 4 мкл смеси молока и активирующего буфера, которые были покрыты покровным стеклом при контролируемом давлении. Сперму в анализируемом поле регистрировали в течение 30 секунд. Подвижные сперматозоиды, которые маркировали пути, анализировали с помощью CASA с использованием ряда алгоритмов. Анализировали первичные параметры: процент подвижных сперматозоидов (МОТ, %), среднюю скорость прохождения (VAP, м/с), криволинейную скорость (VCL, м/с), прямолинейную скорость движения сперматозоидов (VSL, м/с). ), среднее угловое смещение (MAD, °), амплитуда бокового смещения головы (ALH, pm), поперечная частота биений (BCF, Гц).
Температура столика микроскопа, на котором проводились испытания, составляла около 15°С. Подвижность сперматозоидов активировали буфером Янихена в соотношении 1:25 (100 мкл молока смешивают с 2500 мкл активирующей жидкости), состоящим из 10 мМ трис-HCl, 20 мМ NaCl, 2 мМ CaCl2 и pH 8,5 (Jahnichen et al. 1999), и препарат перемешивали как можно быстрее. Измерения проводились примерно через 5-10 секунд после начала подвижности сперматозоидов. Анализы проводились на 4 мкл смеси молока и активирующего буфера, которые были покрыты покровным стеклом при контролируемом давлении. Сперму в анализируемом поле регистрировали в течение 30 секунд. Подвижные сперматозоиды, которые маркировали пути, анализировали с помощью CASA с использованием ряда алгоритмов. Анализировали первичные параметры: процент подвижных сперматозоидов (МОТ, %), среднюю скорость прохождения (VAP, м/с), криволинейную скорость (VCL, м/с), прямолинейную скорость движения сперматозоидов (VSL, м/с). ), среднее угловое смещение (MAD, °), амплитуда бокового смещения головы (ALH, pm), поперечная частота биений (BCF, Гц). Также были проанализированы следующие вторичные параметры, т. е. линейность (LIN, %), прямолинейность траектории (STR, %) и импульс (MOM, м с 1). Молоки каждого образца были активированы дважды, чтобы их можно было наблюдать два раза. В статистическом анализе использовали средние значения результатов CASA.
Также были проанализированы следующие вторичные параметры, т. е. линейность (LIN, %), прямолинейность траектории (STR, %) и импульс (MOM, м с 1). Молоки каждого образца были активированы дважды, чтобы их можно было наблюдать два раза. В статистическом анализе использовали средние значения результатов CASA.
Статистический анализ
Различия в подвижности спермиев стерляди и сибирского осетра оценивали с помощью независимого критерия Стьюдента (P < 0,05). Критерий Колмогорова-Смирнова был применен для оценки нормального распределения. Статистический анализ выполнен с помощью STATISTICA 8.0 PL и Excel 2007.
Результаты
Подвижность спермы сибирского осетра и стерляди после сбора и до активации
Значения подвижности спермы сибирского осетра и стерляди после сбора без активации представлены в таблице 1. Подвижность единичных сперматозоидов в молоке обоих видов до активации составляло около 2%.
Параметры подвижности сперматозоидов сибирского осетра и стерляди, определенные с помощью CASA
CASA выявил большую долю подвижных сперматозоидов в сперме стерляди (44,8%), чем в сперме сибирского осетра (41,3%), но эта разница не была достоверной (табл. 1). ). Сперма обоих исследованных видов была одинаковой в отношении скорости, и это сходство также имело место в значениях VAP (97,6 и 102,4 пм/с), VCL (121,9 и 119,9 пм/с) и VSL (82,5 и 86,8). пм с-1). Статистически значимых различий между спермой сибирского осетра и стерляди по значениям ALH, BCF, LIN, STR и MOM не наблюдалось.
1). ). Сперма обоих исследованных видов была одинаковой в отношении скорости, и это сходство также имело место в значениях VAP (97,6 и 102,4 пм/с), VCL (121,9 и 119,9 пм/с) и VSL (82,5 и 86,8). пм с-1). Статистически значимых различий между спермой сибирского осетра и стерляди по значениям ALH, BCF, LIN, STR и MOM не наблюдалось.
Таблица 1
Показатели подвижности сперматозоидов в свежей сперме сибирского осетра (Acipenser baerii) и стерляди (Acipenser ruthenus). Среднее арифметическое (M), стандартное отклонение (SD), стандартная ошибка среднего (SEM), минимальное значение (min), максимальное значение (max). Группы с разными буквенными индексами в одном ряду различаются статистически значимо (P < 0,05)
Сибирский осетр (n=15) Стерлядь (n=15)
Показатель M SD SEM min max M SD SEM min max
Подвижность сперматозоидов без активации (%) 2,4 2,5 0,7 0 10 1,4 1,7 0,7 0 10
Процент подвижных сперматозоидов МОТ (%) 41,3 14,1 2,6 27 78 44,8 17,5 2,9 24 71
Средние скорости пути VAP-1) 97. 6 14.0 3.6 77.7 124.8 102.4 12.0 3.1 80.2 118.9
6 14.0 3.6 77.7 124.8 102.4 12.0 3.1 80.2 118.9
Curvilinear velocity VCL (pm s-1) 121.9 17.3 4.5 92.6 149.4 119.9 19.1 4.9 94.9 158.2
Straight line velocity VSL (pm s-1) 82.5 14.3 3.7 60.3 103.3 86.8 9.3 2,4 71,1 98,2
Среднее угловое смещение MAD (°) 70,7a 19.1 4.9 41.1 98.8 33.5b 10.4 2.7 22.8 62.8
Amplitude of lateral head
displacement ALH (pm) 10.4 2.7 0.7 7.0 16.1 12.8 3.4 0.9 7.4 18.3
Beat cross frequency BCF (Hz) 4.9 0.8 0.2 3.7 6.4 3.7 1.0 0,3 2,4 6,0
Linearity Lin (%) 58,6 11,0 2,8 40,6 83,2 55,1 6,2 1,6 47,0 70,4
Прямость STR (%) 82,3 9,9 2,6 65,4 97,0 72,5 11,1 2,9 57,7 92,8
Momentum Mom (M S————————————————————————————————————, 2586 6502 3955 904 307 1177 5235
Только по значениям МАД подтверждена статистически значимая разница между спермой сибирского осетра и стерляди (табл. 1).
Обсуждение
Результаты настоящего исследования показывают, что использование CASA позволило точно оценить подвижность сперматозоидов у двух исследованных видов рыб, что позволяет определить потенциальную пригодность спермы для воспроизводства осетровых рыб. Субъективная оценка подвижности сперматозоидов, которая является основным параметром стандартных тестов качества спермы, зачастую является единственным методом, применяемым в репродуктивных исследованиях. Однако многие авторы продемонстрировали, что субъективная оценка подвижности сперматозоидов не очень важна для определения фертильности или прогнозирования результатов оплодотворения (Aitken et al. 19).82, Бартоов и др. 1993). Оценки одной и той же спермы, выполненные опытными аналитиками с использованием субъективного метода, существенно различаются. Эти различия особенно значительны при оценке параметров подвижности и достигают от 30 до 60% (Amann, 1989, Barros et al., 1973, Budworth et al., 1988). Это может быть
Субъективная оценка подвижности сперматозоидов, которая является основным параметром стандартных тестов качества спермы, зачастую является единственным методом, применяемым в репродуктивных исследованиях. Однако многие авторы продемонстрировали, что субъективная оценка подвижности сперматозоидов не очень важна для определения фертильности или прогнозирования результатов оплодотворения (Aitken et al. 19).82, Бартоов и др. 1993). Оценки одной и той же спермы, выполненные опытными аналитиками с использованием субъективного метода, существенно различаются. Эти различия особенно значительны при оценке параметров подвижности и достигают от 30 до 60% (Amann, 1989, Barros et al., 1973, Budworth et al., 1988). Это может быть
объяснено многими причинами, включая переменное качество эякулята, отсутствие определенной зависимости различных параметров от способности к оплодотворению и описательный характер тестов, которые подвержены значительным колебаниям и ошибкам интерпретации (Bostofte et al. 19).82, Дженсен и др. 1997). По сравнению с субъективными методами, которые сопряжены со значительной ошибкой и ограничены определением доли подвижных сперматозоидов, CASA позволяет проводить объективные измерения примерно пятнадцати параметров подвижности, которые важны для успешного оплодотворения икры (Gage et al. 2004). Об этом свидетельствует положительная корреляция между процентом подвижной спермы и оплодотворением у рыб (Wilson-Leedy and Ingermann 2007).
19).82, Дженсен и др. 1997). По сравнению с субъективными методами, которые сопряжены со значительной ошибкой и ограничены определением доли подвижных сперматозоидов, CASA позволяет проводить объективные измерения примерно пятнадцати параметров подвижности, которые важны для успешного оплодотворения икры (Gage et al. 2004). Об этом свидетельствует положительная корреляция между процентом подвижной спермы и оплодотворением у рыб (Wilson-Leedy and Ingermann 2007).
Целью оценки подвижности сперматозоидов после сбора и до активации было определение того, была ли сперма загрязнена мочой во время сбора. У большинства видов рыб сперматозоиды в семенниках и семявыносящих протоках неподвижны, и активация происходит только при контакте молок с водой, мочой или активирующей жидкостью. Продолжительность подвижности сперматозоидов зависит от вида и у осетровых составляет несколько часов (Toth et al. 19).97), несколько минут у карпа и щуки, Esox lucius L., и несколько секунд у атлантического лосося, Salmo salar L. и радужной форели (Koldras and Bieniarz 1995). Активация сперматозоидов, инициируемая мочой, была описана у большого сома, Silurus glanis L., карпа, тюрбо, Scophthalmus maximus (L.), тиляпии, Oreochromis mossambicus (Peters) и линя, Tinca tinca (L.) (Rurangwa et al. , 2004). Во многих случаях причиной контаминации является близкое расположение семявыводящего протока к мочеточнику. Значительное загрязнение мочи может снизить качество молока, что наблюдается у карпа, сома и палтуса (Dreanno et al. 19).98). Существуют также виды рыб, например пятнистая зубатка, сперма которых активна в течение нескольких часов без активации, в отличие от большинства костистых, а в морских водах они становятся неподвижными (Kime, Tveiten 2002). В текущем исследовании небольшой процент сперматозоидов был активен сразу после сбора спермы и до активации. Пока неизвестно, является ли это неоднократно отмечавшееся явление нормальной физиологией репродуктивной биологии самцов
и радужной форели (Koldras and Bieniarz 1995). Активация сперматозоидов, инициируемая мочой, была описана у большого сома, Silurus glanis L., карпа, тюрбо, Scophthalmus maximus (L.), тиляпии, Oreochromis mossambicus (Peters) и линя, Tinca tinca (L.) (Rurangwa et al. , 2004). Во многих случаях причиной контаминации является близкое расположение семявыводящего протока к мочеточнику. Значительное загрязнение мочи может снизить качество молока, что наблюдается у карпа, сома и палтуса (Dreanno et al. 19).98). Существуют также виды рыб, например пятнистая зубатка, сперма которых активна в течение нескольких часов без активации, в отличие от большинства костистых, а в морских водах они становятся неподвижными (Kime, Tveiten 2002). В текущем исследовании небольшой процент сперматозоидов был активен сразу после сбора спермы и до активации. Пока неизвестно, является ли это неоднократно отмечавшееся явление нормальной физиологией репродуктивной биологии самцов
осетровых или результатом загрязнения молок водой или мочой (Glogowski et al. 2002).
2002).
CASA указал, что средняя скорость движения (VAP) и скорость движения по прямой (VSL) спермы в свежей сперме стерляди были выше по сравнению со спермой сибирского осетра. Глоговски и др. (2004) также сообщили о более высоких средних значениях VAP и VSL в сперме стерляди 133,3 pm 1 и 97,4 pm 1 соответственно по сравнению со спермой сибирского осетра при 115,9 pm s 1 и 97,1 pm s 1 соответственно. Сперма русского осетра Acipenser gueldenstaedtii Brandt характеризовалась самым высоким средним VAP (144,9).пм с-1) и VSL (123,9 пм с 1). Церешко и др. (1996) определили значение VSL в свежей сперме озерного осетра Acipenser fulvescens Rafinesque равным 106,5 пм/с. Имеются исследования, в которых сообщается о положительной зависимости между значениями VSL и процентом экстракорпорального оплодотворения (Liu et al., 1991). . Среди всех параметров подвижности сперматозоидов, оцененных Rurangwa et al. (2004) с использованием CASA параметры VCL, VSL и VAP лучше всего коррелировали с процентом оплодотворения. Сходные корреляции между этими параметрами CASA и способностью к оплодотворению были подтверждены у палтуса (Dreanno et al. 19).99), радужная форель (Lahnsteiner 2000), карп (Linhart et al. 2000) и морской сом (Rurangwa et al. 2001). В настоящем исследовании средние значения ЖЕЛ у сибирского осетра и стерляди были близки при 121,9 и 119,9 пм/с соответственно. Более ранние исследования показали, что средние значения VCL составляли 137,4 пм/с у сибирского осетра, 150,0 пм/с у стерляди и 159,5 пм/с у русского осетра (Glogowski et al. 2004). Церешко и др. (1996) сообщили о гораздо более высоких средних значениях VCL у озерного осетра при 336,1 пм/с.
Сходные корреляции между этими параметрами CASA и способностью к оплодотворению были подтверждены у палтуса (Dreanno et al. 19).99), радужная форель (Lahnsteiner 2000), карп (Linhart et al. 2000) и морской сом (Rurangwa et al. 2001). В настоящем исследовании средние значения ЖЕЛ у сибирского осетра и стерляди были близки при 121,9 и 119,9 пм/с соответственно. Более ранние исследования показали, что средние значения VCL составляли 137,4 пм/с у сибирского осетра, 150,0 пм/с у стерляди и 159,5 пм/с у русского осетра (Glogowski et al. 2004). Церешко и др. (1996) сообщили о гораздо более высоких средних значениях VCL у озерного осетра при 336,1 пм/с.
В доступной литературе мало информации о параметре MAD и его связи со степенью оплодотворения. Проведенный анализ показал статистически значимо более высокое среднее значение МАД в сперме сибирского осетра (70,7°) по сравнению со спермой стерляди (33,5°). В исследовании Kime and Tveiten (2002) сообщается о значении MAD у свежевыловленной пятнистой зубатки 94°, что, по мнению авторов, является очень высоким средним значением по сравнению с другими костистыми рыбами (30-40°).
В текущем исследовании значительные различия в качестве спермы отдельных мужчин наблюдались по многим параметрам подвижности сперматозоидов. Различия, отмеченные в подвижности сперматозоидов, могли быть связаны с разными периодами сбора спермы, а также с различиями между отдельными экземплярами, такими как возраст, масса тела или общее физическое состояние или здоровье рыбы. Эти предположения могут быть подтверждены высокими значениями стандартного отклонения среди данного вида осетровых. Различия в подвижности сперматозоидов у отдельных самцов сибирского осетра и стерляди были подтверждены в исследованиях Billard (19).86). Подобные колебания качества спермы в пределах данного вида также были подтверждены у карпа, щуки и гуппи Poecilia reticulata Peters (Billard 1986).
Выводы
• Низкая подвижность сперматозоидов после сбора спермы и до активации может указывать на то, что метод сбора, использованный для этих осетровых, является подходящим.
• CASA позволил точно определить подвижность сперматозоидов после активации, что, в свою очередь, позволило оценить потенциальную пригодность спермы для размножения осетровых рыб.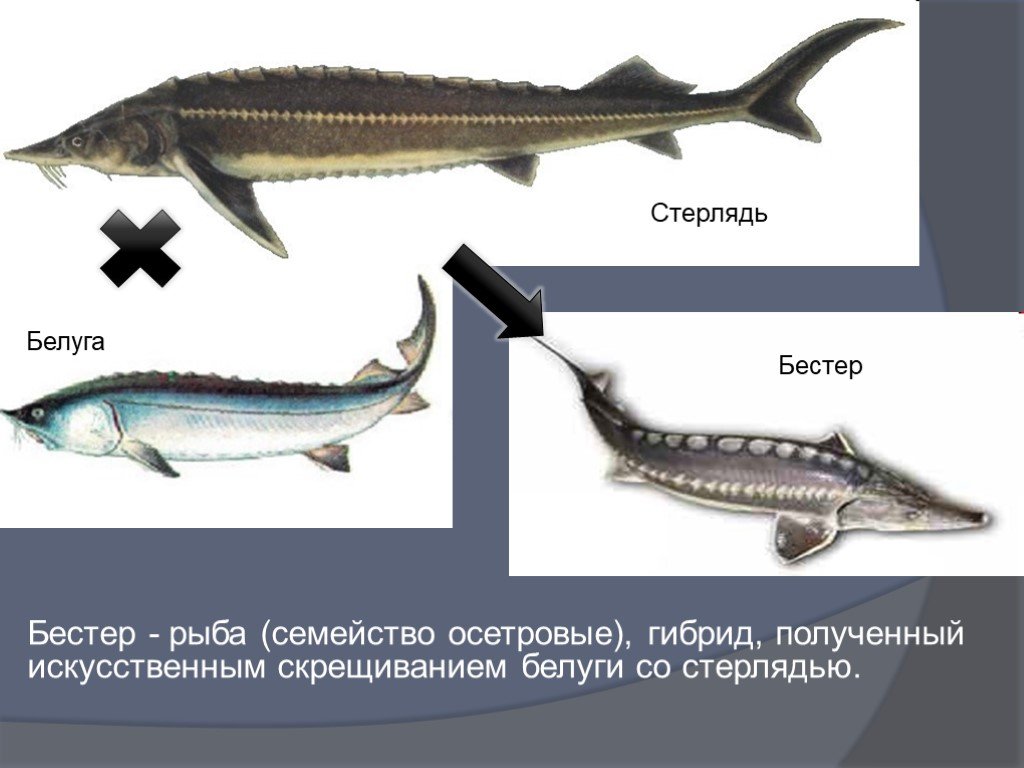 Биологического сходства между признаками подвижности сперматозоидов сибирского осетра и стерляди было много, и наибольшее из них было отмечено в значениях ВАП, ЖЕЛ и ЖЕЛ.
Биологического сходства между признаками подвижности сперматозоидов сибирского осетра и стерляди было много, и наибольшее из них было отмечено в значениях ВАП, ЖЕЛ и ЖЕЛ.
• Выявлены значительные различия в индивидуальных параметрах подвижности сперматозоидов у самцов одного и того же вида осетровых. Высокие значения стандартного отклонения могут указывать на различное качество спермы, что предполагает возможные различия в возможностях оплодотворения.
Благодарности. Авторы выражают благодарность Рышарду Кольману за создание благоприятных условий и обеспечение доступа к биологическим материалам для исследования. Благодарим также Вальдемара Кучински за предоставление доступа к аналитическому оборудованию. Исследование выполнено в рамках обязательных научных исследований на кафедре биологии гамет и эмбрионов.
Авторские вклады. P.S. провел эксперимент, проанализировал результаты и описал их; Дж.Г. обеспечивал наблюдение за всем экспериментом, B.I.C. описал результаты; К. Г. провели статистический анализ результатов.
Г. провели статистический анализ результатов.
Ссылки
Айткен Р.Дж., Бест Ф.С., Ричардсон Д.В., Джаханбакч О., Лис М.М. 1982 — Корреляты способности к оплодотворению у нормально фертильного мужчины — J. Androl. 38: 68-76. Аманн Р.П. 1989 — Можно ли точно предсказать фертильность образца семенной жидкости? — Дж. Андрол. 10:89-98. Бартов Б., Эльтес Ф., Пански М., Ледерман Х., Каспи Э., Соффер Ю. 1993 — Оценка потенциала фертильности по данным анализа спермы — Hum. Воспр. 8: 65-70. Barros C., Fujimoto M., Yanagimachi R. 1973 — Отсутствие проникновения в зону сперматозоидов хомяков после длительной предварительной инкубации во фракции сыворотки крови — J. Reprod. Плодородный. 35: 89-95. Billard R. 1986 — Сперматогенез и сперматология теле-
ost видов рыб — Reprod. Нутр. Дев. 26: 877-920. Бостофт Э., Серуп Дж., Ребе Х. 1982 — Связь между количеством сперматозоидов и объемом спермы и беременностями, полученными в течение двадцатилетнего периода наблюдения — Int. Дж. Андрол. 3: 267-275. Budworth P., Amann R., Chapman P. 1988 — Взаимосвязь между компьютеризированными измерениями движения замороженных размороженных сперматозоидов быков и фертильностью — J. Androl. 9: 41-54.
3: 267-275. Budworth P., Amann R., Chapman P. 1988 — Взаимосвязь между компьютеризированными измерениями движения замороженных размороженных сперматозоидов быков и фертильностью — J. Androl. 9: 41-54.
Церешко А., Тот Г.П., Христос С.А., Домбровски К. 1996 — Влияние криоконсервации и теофиллина на характеристики подвижности сперматозоидов озерного осетра (Acipenser fulvescens) — Териогенология 45: 665-672. Коссон Дж., Линхарт О., Мимс С.Д., Шелтон В.Л., Родина М. 2000 — Анализ параметров подвижности сперматозоидов веслоноса и лопатоноса — J. Fish Biol. 56: 1348-1367.
Дитрих Г.Дж., Ковальски Р., Войтчак М., Добош С., Горыцко К., Церешко А. 2005 — Параметры подвижности сперматозоидов радужной форели (Oncorhynchus mykiss) в зависимости от последовательного сбора молока, время посмертного хранения и анестезия — Фиш Физиол. Биохим. 31: 1-9. Дитрих Г.Дж., Дитрих М., Ковальски Р.К., Добош С., Кароль Х., Демьянович В., Глоговски Дж. 2010 — Воздействие ртути и кадмия на молоки радужной форели изменяет параметры подвижности сперматозоидов и репродуктивный успех — Aquat. Токсикол. 97: 277-284. Дрианно К., Сюке М., Десбрюйерес Э., Коссон Дж., Деллиу Х., Биллард Р. 1998 — Влияние мочи на качество спермы тюрбо (Psetta maxima) — Аквакультура 169: 247-262.
Токсикол. 97: 277-284. Дрианно К., Сюке М., Десбрюйерес Э., Коссон Дж., Деллиу Х., Биллард Р. 1998 — Влияние мочи на качество спермы тюрбо (Psetta maxima) — Аквакультура 169: 247-262.
Dreanno C., Cosson J., Suquet M., Seguin F., Dorange G., Billard R. 1999 — Содержание нуклеотидов, окислительное фосфорилирование, морфология и оплодотворяющая способность сперматозоидов палтуса (Psetta maxima) в период подвижности — Mol . Воспр. Дев. 53: 230-243.
ЭШРЕ. 1998 г. — Руководство по применению технологии CASA при анализе сперматозоидов — Hum. Воспр. 13: 142-145.
Гейдж М.Дж.Г., Макфарланс С.П., Йейтс С., Уорд Р.Г., Сирл Дж.Б., Паркер Г.А. 2004 — Свойства сперматозоидов и конкуренция сперматозоидов у атлантического лосося: относительная скорость сперматозоидов является основным фактором, определяющим успех оплодотворения — Curr. биол. 14: 44-47.
Глоговски Ю., Колман Р., Щепковски М., Хорват А., Урбани Б., Сечинский П., Жеменецкий А., Домагала Ю., Демьянович В. , Ковальски Р., Церешко А. 2002 — Коэффициент оплодотворения Молоко сибирского осетра (Acipenser baeri, Brandt) криоконсервировано метанолом — Аквакультура 211: 367-373. 9s Z. 2010 — Влияние дибутилфталата и бензилбутилфталата на параметры подвижности сперматозоидов европейского судака Sander lucioperca (L.) — Arch. пол. Рыбы. 18: 149-156.
, Ковальски Р., Церешко А. 2002 — Коэффициент оплодотворения Молоко сибирского осетра (Acipenser baeri, Brandt) криоконсервировано метанолом — Аквакультура 211: 367-373. 9s Z. 2010 — Влияние дибутилфталата и бензилбутилфталата на параметры подвижности сперматозоидов европейского судака Sander lucioperca (L.) — Arch. пол. Рыбы. 18: 149-156.
Jähnichen H., Warnecke D., Trölsch E., Kohlmann K., Bergler H., Pluta HJ 1999 — Подвижность и способность к оплодотворению криоконсервированных сперматозоидов Acipenser ruthenus L. — J. Appl. Ихтиол. 15: 2004-206.
Дженсен Т.К., Андерссон А.М., Хьоллунд Н.Х., Шайке Т., Колстад Х., Гиверцман А., Йоргенсен Н., Аугер Дж., Гиверкман А., Ирвин Д.С., Дженсен Т.К., Жуанне П., Кейдинг Н., Ле Бон С., Макдональд Э., Пекури А.М. 1997 — Анализ спермы, выполненный разными группами лабораторий: интервариантное исследование — Int. Дж. Андрол. 20: 201-208.
Kime D.E., Ebrahimi M., Nysten K., Roelants I., Rurangwa E., Moore HDM, Ollevier F. 1996 — Использование компьютерного анализа спермы (CASA) для мониторинга воздействия загрязнения на качество спермы рыб; применение при воздействии тяжелых металлов — Акват. Токсикол. 36: 223-237.
Токсикол. 36: 223-237.
Kime D.E., Tveiten H. 2002 — Необычные характеристики подвижности сперматозоидов пятнистого волка — J. Fish Biol. 61: 1549-1559.
Колман Р., Щепковска Б., Щепковски М. 1998 — Созревание осетровых рыб на экспериментальном рыбоводном заводе Дгал-Комун. Рыб. 4: 9-11 (на польском языке).
Колдрас М., Биниарз К. 1995 — Исследования спермы рыб и ее хранения при низких температурах — Арх. По. Рыбы. 3 (1): 13-18 (на польском языке).
Lahnsteiner F. 2000 — Криоконсервация спермы лососевых и северной щуки — Aquac. Рез. 31: 245-258.
Линхарт О., Родина М., Коссон Дж. 2000 — Криоконсервация спермы карпа Cyprinus carpio: подвижность сперматозоидов и успех вылупления эмбрионов — Криобиология 41: 241-250.
Лю Д.Ю., Кларк Г.Н., Бейкер Х.Г.В. 1991 — Взаимосвязь между подвижностью сперматозоидов, оцененной с помощью анализатора подвижности Гамильтона-Торна, и частотой оплодотворения in vitro
— J. Androl. 12: 231-239.
Мимс С. Д., Шелтон В.Л. 1998 — Индуцированный мейотический гиногенез у лопатоноса — Аквакульт. Междунар. 6: 323-329.
Д., Шелтон В.Л. 1998 — Индуцированный мейотический гиногенез у лопатоноса — Аквакульт. Междунар. 6: 323-329.
Moccia R.D., Munkittrick K.R. 1987 — Связь между оплодотворением икры радужной форели (Salmo gairdneri) и подвижностью сперматозоидов — Териогенология 27: 679-688.
Равиндер К., Насаруддин К., Маджумдар К.С., Шивай С. 1997 — Компьютерный анализ подвижности, моделей подвижности и параметров подвижности сперматозоидов карпа после кратковременного хранения спермы — J. Fish Biol. 50: 1309-1328.
Rurangwa E., Volckaert F.A.M., Huyskens G., Kime D.E., Ollevier F. 2001 — Контроль качества охлажденной и криоконсервированной спермы с использованием компьютерного анализа спермы (CASA), жизнеспособного окрашивания и стандартизированного оплодотворения африканского сома (Clarias gariepinus) -Териогенология 55: 751-769.
Rurangwa E., Kime D.E., Ollevier F., Nash J.P. 2004 – Измерение подвижности сперматозоидов и факторы, влияющие на качество сперматозоидов у культивируемых рыб – Aquaculture 234:1-28.