Содержание
Паразиты крови некоторых видов рыб Нижнего Иртыша | Либерман
1. Авдеева Е. В., Евдокимова Е. Б., Заостровце ва С. К. Современное состояние изучения паразитофауны рыб водоемов Калининградской области // Научный журнал Известия КГТУ. 2017. № 45. С. 24-61.
2. Алигаджиев А. Д. Влияние длительного осушения водоема на паразитофауну его рыб // Паразитология. 1969. Т. III, № 2. С. 144-148.
3. Аннотированный список фауны озера Байкал и его водосборного бассейна: В 2-х томах. Озеро Байкал, Т. I: кн. 1. Новосибирск: Наука, 2001. С. 122-125.
4. Быховская-Павловская И. Е. Паразитологическое исследование рыб. В серии: Методы паразитологических исследований. Л.: Наука, 1969. В. 1. 109 с.
5. Гусейнов М. А. Сезонные изменения зараженности щуки (Esox lucius L.) Девечинского лимана кровепаразитами // «Биоразнообразие и экология паразитов наземных и водных ценозов»: Материалы Международной научной конференции, посвященной 130-летию со дня рождения акад. К. И. Скрябина. М. , 2008. С. 96-98.
, 2008. С. 96-98.
6. Жохов А. Е., Молодожникова Н. М. Таксономическое разнообразие паразитов рыбообразных и рыб бассейна Волги. I. Паразитические простейшие (Protozoa) // Паразитология. 2006. Т. 40, № 3. С. 244-274.
7. Кириллов А. А., Кириллова Н. Ю., Евланов И. А. Паразиты рыб (Pisces) Самарской области. Сообщение 1. Euglenozoa, Polymastigota, Protozoa, Microsporidia, Cnidaria, Ciliophora и Neomonada // Известия Самарского научного центра Российской академии наук. 2018. Т. 20, № 5 (4). С. 637-651.
8. Лапкина Л. Н., Жарикова Т. И., Свирский А. М. Зараженность рыб пиявками (Сем. Piscicolidae) в Волжских водохранилищах // Паразитология. 2002. Т. 36, № 2. С. 132-139.
9. Лихачёв С. Ф., Губанов Е. Е. Таксономическое разнообразие паразитических простейших рыб из некоторых водоёмов Омской области // Омский научный вестник. 2006. № 9 (46). С. 241243.
10. Любарская О. Д., Лаврентьева Ю. И. Паразитофауна стерляди средней Волги и Куйбышевского водохранилища // Паразитология. 1985. № 19 (4). С. 320-323.
1985. № 19 (4). С. 320-323.
11. Определитель паразитов пресноводных рыб фауны СССР. Паразитические простейшие. Л.: Наука, 1984. Т. 1. 428 с.
12. Правдин И. Ф. Руководство по изучению рыб (преимущественно пресноводных) (4-е изд.): учеб. пособ. М.: Пищ. пром-сть, 1966. 376 с.
13. Пугачев О. Н. Каталог паразитов пресноводных рыб Северной Азии. Нематоды, скребни, пиявки, моллюски, ракообразные, клещи. СПб., Тр. ЗИН РАН, 2004. Т. 304. С. 106.
14. Тирахов А. Д., Кутнякова Д. Ю., Бочагова А. В. К изучению паразитофауны рыб реки Улеймы // «Актуальные проблемы экологии Ярославской области»: Материалы Третьей науч.-практ. конференции. Ярославль: Издание ВВО РЭА, 2005. В. 3, Т. 1. С. 299-303.
15. Тромбицкий И. Д. Картина крови прудовых рыб в норме и при паразитарных заболеваниях: автореф. дис. … канд. биол. наук. Рыбное, 1984. 21 с.
16. Тряпицына Г. А., Пряхин Е. А., Осипов Д. И., Егорейченков Е. А., Рудольфсен Г., Тейен Х.-К., Сневе М., Аклеев А. В. Реакция эритропоэза на трипаносомную инвазию у рыб, обитающих в радиоактивно загрязненной реке Теча // Радиационная биология. Радиоэкология. 2019. Т. 59, № 1. С. 82–93. doi:10.1134/S0869803119010119.
Радиоэкология. 2019. Т. 59, № 1. С. 82–93. doi:10.1134/S0869803119010119.
17. Хайбулаев К. X. О роли пиявок в жизненном цикле кровепаразитов рыб // Паразитология. 1970. Т. IV, № 1. С. 13-17.
18. Хамнуева Т. Р., Балданова Д. Р. Первое обнаружение гемогрегарин у рыб озера Байкал // Паразитология. 2016. В. 50, № 1. С. 92-95.
19. Шульман С. С. Обзор фауны паразитов осетровых рыб // Зоологический журнал. 1954. № 33 (1). С. 190-254.
20. Экология рыб Обь-Иртышского бассейна / под ред. Павлов Д. С., Мочек А. Д. М.: Тов-во научных изданий КМК, 2006. 596 с.
21. Baska F. Chloromyxum inexpectatum n. sp. and Sphaerospora colomani n. sp. (Myxozoa: Myxosporea) parasites of the urinary system of the sterlet, Acipenser ruthenus L. Systematic parasitology. 1990; 16: 185-193. doi:10.1007/bf00009146.
22. Bauer O. N., Pugachev O. N., Voronin V. N. Study of parasites and diseases of sturgeons in Russia: a review. Journal of Applied Ichthyology. 2002; 18: 420-429. doi:10.1046/j. 1439-0426.2002.00422.x.
1439-0426.2002.00422.x.
23. Bunnajirakul S., Steinhagen D., Hetzel U., Körting W., Drommer W. A study of sequential histopathology of Trypanoplasma borreli (Protozoa: Kinetoplastida) in susceptible common carp Cyprinus carpio. Diseases of Aquatic Organisms. 2000; 39. 221-229. doi:10.3354/dao039221.
24. Curtis L. M., Grutter A. S., Smit N. J., Davies A. J. Gnathia aureamaculosa, a likely definitive host of Haemogregarina balistapi and potential vector for Haemogregarina bigemina between fishes of the Great Barrier Reef, Australia. International ФАУНА, МОРФОЛОГИЯ И СИСТЕМАТИКА ПАРАЗИТОВ Journal for Parasitology. 2013; 43 (5): 361-370. doi:10.1016/j.ijp.
25. Esteves-Silva P. H., Lucas da Silva M. R., O’Dwyer L. H. et al. Haemogregarina daviesensis sp. nov. (Apicomplexa: Haemogregarinidae) from South American lungfish Lepidosiren paradoxa (Sarcopterygii: Lepidosirenidae) in the eastern Amazon region. Parasitol. Res. 2019; 118: 27732779. doi:10.1007/s00436-019-06430-7.
26. Liberman E. L., Voropaeva E. L. The parasitofauna of the Siberian sterlet Acipenser ruthenus marsiglii of the Lower Irtysh. Regul. Mech. Biosyst. 2018; 9 (3): 329-334. https://doi.org/10.15421/021848.
Liberman E. L., Voropaeva E. L. The parasitofauna of the Siberian sterlet Acipenser ruthenus marsiglii of the Lower Irtysh. Regul. Mech. Biosyst. 2018; 9 (3): 329-334. https://doi.org/10.15421/021848.
27. Losev A., Grybchuk-Ieremenko A., Kostygov A. Y., Lukeš J., Yurchenko V. Host specificity, pathogenicity, and mixed infections of trypanoplasms from freshwater fishes. Parasitol Res. 2015; 114 (3): 1071-8. doi:10.1007/s00436014-4277-y.
28. Mark E. Siddall, Sherwin S. Desser. Cytopathological Changes Induced by Haemogregarina myoxocephali in Its Fish Host and Leech Vector. Journal of Parasitology. 1993; 79 (2): 297-301. doi:10.2307/3283526.
29. McAllister M., Phillips N., Belosevic M. Trypanosoma carassii infection in goldfish (Carassius auratus L.): changes in the expression of erythropoiesis and anemia regulatory genes. Parasitology Research. 2019; 118: 1147-1158. doi:10.1007/s00436-019-06246-5.
30. Pazooki J., Masoumian M. Cryptobia acipenseris and Haemogregarina acipenseris infections in Acipenser guldenstadti and A. persicus in the Southern part of the Caspian Sea. Journal of Agricultural Science and Technology. 2004; 6: 95-101.
persicus in the Southern part of the Caspian Sea. Journal of Agricultural Science and Technology. 2004; 6: 95-101.
31. Qadri S. Sh. An experimental study of the life cycle of Trypanosoma danilewskyi in the leech, Hemiclepsis marginata. Protozool. 1962; 9 (3): 254-258.
32. Saunders D. Haemogregarina bigemina Laveran & Mesnil from Marine Fishes of Bermuda. Transactions of the American Microscopical Society. 1959; 78 (4): 374-379. doi:10.2307/3224154.
Каждый третий заболевший описторхозом россиянин — из Югры | Общество
В Югре проходит месячник, посвящённый профилактике описторхоза. В медицинских учреждениях проходят дни открытых дверей, медики рассказывают о мерах профилактики и последствиях заболевания. Описторхоз – это одно из самых распространённых заболеваний в Югре. По статистике, каждый третий заражённый описторхозом в стране — житель нашего округа. Каждый год описторхоз выявляют у 10 тысяч югорчан.
Кусочек рыбы растворяют в специальном растворе, который по составу похож на желудочный сок. В такой кислой среде личинки описторха начинают выходить из своих капсул.
В такой кислой среде личинки описторха начинают выходить из своих капсул.
Валентина Шалагина, лаборант-паразитолог: «Он там колышется-колышется, спускаем желчь, подогреваем над спиртовочкой, он еще больше у нас начинает шевелиться, протыкает оболочку и выходит наружу. И мы можем видеть живую личинку описторхоза».
Из желудка человека освобожденная личинка попадает прямиком в желчный пузырь и печень. Это чревато развитием таких заболеваний, как цирроз, панкреатит и даже рак. Потенциальные носители описторхов — это рыбы карповых пород. Самый опасный из них — язь. На одном квадратном сантиметре этой рыбы находят сразу до двух десятков личинок.
Надежда Остапенко, начальник отдела эпиднадзора Управления Роспотребнадзора по Югре: «Вопреки бытующему мнению, через благородную рыбу — через стерлядь, муксун, нельму — заразиться описторхозом нельзя. Нельзя заразиться даже через щуку, окунь и другую рыбу».
Продавцы магазина регулярно сдают анализы на описторхоз. Однако паразитов ни у одного из них врачи не нашли. Дело в том, что работники торговли приобретают рыбу только в своем магазине. На прилавок она поступает с рыбокомбината, где ее обеззараживают.
Однако паразитов ни у одного из них врачи не нашли. Дело в том, что работники торговли приобретают рыбу только в своем магазине. На прилавок она поступает с рыбокомбината, где ее обеззараживают.
Алина Тарасова, технолог рыбокомбината: «Во-первых, рыба вымораживается в течение 20 дней в скороморозке при температуре — 25 градусов. Дальше уже происходит отбор проб с каждой поступившей партии».
Только сертификат качества является залогом безопасности рыбной продукции. У рыбаков таких документов нет. А значит, узнать при покупке, заражена рыба или нет, невозможно. Обезопасить себя, положив рыбу в морозилку, не получится. Температура в домашней морозильной камере всего минус 4 градуса, а для обеззараживания она должна быть минус 25.
Употреблять в пищу можно только хорошо проваренную и прожаренную, тщательно просоленную рыбу. Любителям пикников следует помнить, что правильно приготовить рыбу на костре, скорее всего, не получится. А вот нечаянно глотнув речной воды при купании, паниковать не нужно. Специалисты утверждают — так описторхоз не подхватишь.
Специалисты утверждают — так описторхоз не подхватишь.
Надежда Остапенко, начальник отдела эпиднадзора Управления Роспотребнадзора по Югре: «Потому что у него свой определённый жизненный цикл развития, который предполагает несколько стадий. То есть, это моллюски рода кадиелла, и рыбы карповых пород — там, где он достигает той степени зрелости, когда становится опасным для человека».
Сам человек — носитель инфекции, для других людей тоже опасен. Заболевшие люди выделяют яйца описторхов вместе с продуктами жизнедеятельности. Из канализации они попадают в водоемы, оттуда — в рыбу. Такой вот замкнутый круг.
наиболее распространенных паразитов, встречающихся у осетровых рыб.
Это видео и рисунки наиболее распространенных паразитов, встречающихся у осетровых рыб. Есть и другие, но они вызывают большинство проблем. Я надеюсь, что эти фотографии помогут вам определить правильное лечение для вашей рыбы. Вы можете найти комбинацию паразитов, и некоторые методы лечения не убьют их всех. Если вы можете найти только одного или двух паразитов на какой-либо одной рыбе, вам, вероятно, не нужно их лечить, но внимательно наблюдайте за рыбой. Если, с другой стороны, их много, то лечите сейчас!
Если вы можете найти только одного или двух паразитов на какой-либо одной рыбе, вам, вероятно, не нужно их лечить, но внимательно наблюдайте за рыбой. Если, с другой стороны, их много, то лечите сейчас!
Возможно, вам придется поговорить с ветеринаром, чтобы подтвердить ваш диагноз и лечение.
Рыбья вошь
(Argulus)
Видео с рыбьей вошь (Argulus), снятое Каннаном Абдуллой
Копепода; может вырасти до 10 мм в длину. Он наносит урон, кусая рыбу и вводя яд, чтобы она могла сосать кровь. Он имеет тенденцию питаться в защищенных местах рыбой с хорошим кровоснабжением, например, у основания плавника или вокруг рта.
Аргулус
Затем паразит уплывает, чтобы найти другого хозяина; он может голодать до 3 недель между приемами пищи. Самая большая проблема заключается не только в инъекции яда, но и в оставленной ране, которая довольно часто приводит к вторичной инфекции, такой как грибок или бактерия.
Паразит становится половозрелым через 5-6 недель, сосет кровь; затем он уплывает, чтобы найти себе пару. Когда он отложил яйца, они вылупляются примерно через 4 недели, что приводит к жизненному циклу 8-9 недель. Это может затруднить их лечение, так как курс лечения может быть довольно длительным.
Когда он отложил яйца, они вылупляются примерно через 4 недели, что приводит к жизненному циклу 8-9 недель. Это может затруднить их лечение, так как курс лечения может быть довольно длительным.
Поскольку осетры плохо переносят лечение, это может стать настоящей проблемой. Лучше всего удалить рыбу и обработать пруд/аквариум, а затем вернуть рыбу обратно.
Сосальщики
(Gyrodactylidae)
Видео жаберного двуустка (Dactylogyrus) Пола К. Вона
Gyrodactylus имеет два крючка на одном конце тела и присасывательный диск на другом. Питается кровью и остатками кожи, чаще встречается на коже, но встречается и в жабрах.
Гиродактиль
Распространяется, всплывая и проходя через жабры другой рыбы, где они затем могут зацепиться и перейти на кожу.
Сосальщики размножаются относительно медленно, так как единовременно рождается только одно животное. Они очень маленькие, менее 0,8 мм в длину; длина большинства из них менее 0,5 мм.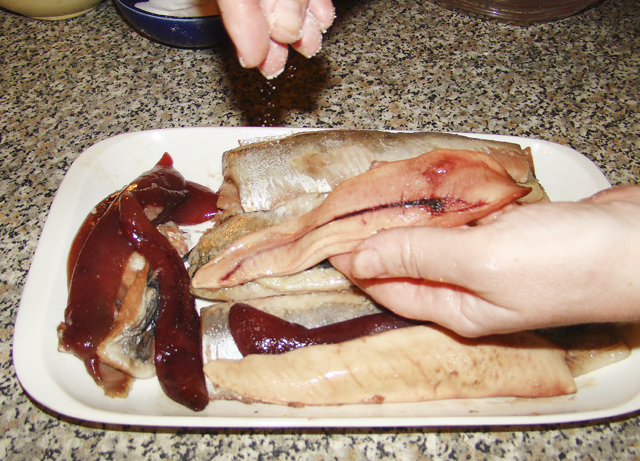
Лучшее лечение: Солевая ванна, 2 унции на галлон в миске с аэрацией. На 15-20 минут.
Триходина
Видео триходины Мишеля ВЕРОЛЕТ
В этой группе много видов, но все они похожи друг на друга и их трудно различить. Так что это обобщение обо всех них. Они часто встречаются в очень больших количествах, когда рыба сначала была ослаблена по другим причинам.
Триходина
Этих шляповидных паразитов легко обнаружить (под микроскопом), так как они имеют реснички (волосы, с помощью которых они передвигаются) по краю и расположение зубов, напоминающее циркулярную пилу, в центре.
Они очень подвижны и передвигаются по коже и жабрам рыбы.
Как правило, они наносят только поверхностные повреждения, но если их количество достаточно велико, а рыба слаба, может наступить смерть. Довольно легко убить, но часто лечение вызывает больше стресса, чем сам паразит.
Проверьте наличие других факторов, которые могли вызвать вспышку, таких как плохое качество воды или низкий уровень кислорода.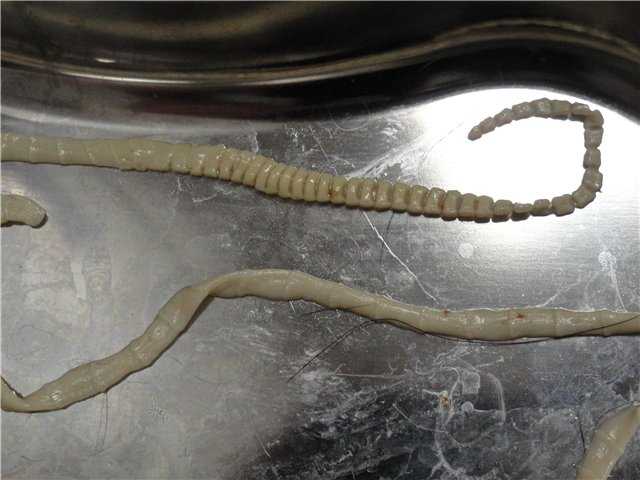 Если цифры станут высокими, осетр погибнет.
Если цифры станут высокими, осетр погибнет.
Лучшее лечение: Солевая ванна, 2 унции на галлон с дополнительной аэрацией в течение 15-20 минут.
Больше видео о рыбных паразитах »
Советы по лечению
Существуют готовые препараты для лечения осетровых рыб, но вы должны следовать инструкциям и этим простым советам.
Прочтите этикетку, в случае сомнений обратитесь к производителю. Да, они должны сказать вам, что в нем (здоровье и безопасность). Если они не могут или не хотят говорить, избегайте лечения.
Обработки, которых следует избегать, включают:
- Сульфат меди, CuSo4.
- Органофосфаты *
- Средства, содержащие формалин/формальдегид
- Перманганат калия
- Любая обработка, в которой указано, что ее нельзя использовать с Golden Orfe (Leciscus sp.) или Красноперкой (Scardinius reythrophathalmus), более чем вероятно убьет осетровых.
* Эти химикаты могут быть опасны для человека и запрещены в Великобритании.
Советы:
- Не давайте корм во время лечения, так как для переваривания пищи рыбам необходимо поглощать кислород. Если вы не можете кормить за день до и день после лечения.
- НИКОГДА не лечите вечером, если что-то пойдет не так, вы не узнаете до утра, а то может быть и поздно!
- Добавить дополнительную аэрацию; некоторые виды лечения истощают уровень кислорода.
- НИКОГДА не смешивайте средства для лечения водорослей и рыб, это пойдет не так!
Другие пункты, которые следует помнить:
- Проверьте качество воды перед лечением, чтобы убедиться, что вода не является причиной; если сначала вылечить эту проблему. Нет смысла лечить, если качество воды плохое, так как рыба не выздоровеет до того, как возникнет следующая проблема!
- Если можете, выключите систему фильтрации, так как некоторые виды обработки убивают фильтрующие бактерии. Не забудьте пропустить немного воды через фильтр, иначе он умрет без кислорода.

- Пропылесосьте пруд, чтобы удалить весь мусор, так как он впитает и разрушит любые химические вещества, которые вы используете.
- Удалите все растения, так как химикаты могут их убить.
- Проверьте свою дозу перед тем, как положить ее в пруд. Не угадаешь, неправильное действие либо не сработает, либо убьет рыбу.
- Добавляйте препараты понемногу в течение часа или около того, чтобы рыба могла переносить отмеренную вами дозу.
- Всегда заканчивайте курс лечения.
НИКОГДА НЕ ПЕРЕДОЗИРОВАТЬ
По окончании лечения ежедневно проверяйте качество воды (аммиак, нитрит), чтобы убедиться, что фильтр работает хорошо.
Опорожните пруд до половины его нормального объема перед обработкой, если это возможно. При этом используется меньше химикатов, что экономит окружающую среду и деньги. Когда закончите, долейте воду в пруд, и все оставшиеся химикаты будут растворены.
НИКОГДА НЕ ИСПОЛЬЗУЙТЕ АНТИБИОТИКИ В ВОДЕ ПРУДА
Это убьет фильтрующие бактерии, и у вас будет больше проблем, чем с самого начала! Всегда берите рыбу купаться, а затем возвращайтесь в пруд.
Written by Terry White & Graham Quick
Новый вид деропристидных трематод из стерляди Acipenser ruthenus (Actinopterygii: Acipenseridae) и пересмотр надсемейной принадлежности семейства Deropristidae
- DOI:10.1093/lazo0072
- ID корпуса: 216532928
@article{Sokolov2020ANS,
title={Новый вид деропристидных трематод из стерляди Acipenser ruthenus (Actinopterygii: Acipenseridae) и ревизия надсемейной принадлежности семейства Deropristidae},
автор={С.Г. Соколов и Екатерина Леонидовна Воропаева и Дмитрий Михайлович Атопкин},
journal={Зоологический журнал Линнеевского общества},
год = {2020},
объем = {190},
страницы = {448-459}
} - Соколов С., Воропаева Е., Атопкин Д.
- Опубликовано 1 октября 2020 г.
- Биология
- Зоологический журнал Линнеевского общества
Новый вид Skrjabinopsolus nudidorsalis sp. ноябрь описан от стерляди Acipenser ruthenus, отловленной в бассейне р. Волги (Россия). Этот вид отличается от ранее описанных сородичей отсутствием желточных фолликулов на спинной стороне тела. Полные последовательности генов 18S рРНК и частичные последовательности генов 28S рРНК, полученные для S. nudidorsalis, являются первыми молекулярными данными для семейства Deropristidae. Результаты филогенетического анализа показывают, что Deropristidae является сестрой…
ноябрь описан от стерляди Acipenser ruthenus, отловленной в бассейне р. Волги (Россия). Этот вид отличается от ранее описанных сородичей отсутствием желточных фолликулов на спинной стороне тела. Полные последовательности генов 18S рРНК и частичные последовательности генов 28S рРНК, полученные для S. nudidorsalis, являются первыми молекулярными данными для семейства Deropristidae. Результаты филогенетического анализа показывают, что Deropristidae является сестрой…
View via Publisher
An opisthorchiid concept of the genus Liliatrema (Trematoda: Plagiorchiida: Opisthorchioidea): an unexpected systematic position
- S. Sokolov, E. Frolov, Semen Novokreshchennykh, D. Atopkin
Biology
- 2020
Морфологический и филогенетический анализы позволяют сделать неожиданный вывод о том, что род Liliatrema принадлежит к Opisthorchioidea, который является хорошо поддерживаемой сестринской группой традиционных описторхиид.
Pseudohurleytrema yolandae n. sp., первая монорхоидная трематода, обнаруженная у Triacanthidae (Tetraodontiformes)
Этот вид отличается размером семенников и яиц, положением яичника и формой желточного мешка и экскреторного пузырька, что указывает на то, что нынешнее подсемейство классификация требует всестороннего пересмотра.
Chelatrematidae сущ. fam., новое семейство дигенетических трематод из Юго-Западных Гат, Индия, созданное на основе морфологических и молекулярных исследований
Филогенетический анализ C. neilgherriensis и сравнительные морфологические исследования относительно представителей других семейств Gorgoderoidea Looss, 1901 выявили молекулярную и морфологическую близость Chelatrema с Paracreptatrematina limi Amin & Myer, 1982, причем последний переносится в этот новый семья.
Разнообразие европейских lissorchiid trematodes от рыб и улиток-хозяев с комментариями относительно валидности рода Parasymphylodora Szidat, 1943
- R.
 Petkevičiūtė, V. Stunėnas, G. Stanevičiūtė
Petkevičiūtė, V. Stunėnas, G. Stanevičiūtė Biology
Журнал гельминтологии
- 2022
P. Marogentic Analysis поддерживает Valiods of Paras -Parasympmismors и P.S. отдельный род, и кариотипическое сходство этих видов находится в соответствии с молекулярно-филогенетическими данными.
Retroporomonorchis pansho n. г., н. sp., необычная монорхиидная трематода, эксплуатирующая атипичного хозяина
- Н. Ви, Т. Крибб, С. Катмор, С. Мартин
Биология, наука об окружающей среде
Систематическая паразитология н.
Первые шаги к реструктуризации проблемного рода Lasiotocus Looss, 1907 (Digenea: Monorchiidae) с предложением четырех новых родов.
Филогенетические доказательства концепции Lissorchiid рода Anarhichotrema Shimazu, 1973 (Trematoda, Digenea)
- S. Sokolov, S. Shchenkov, I. Gordeev
Биология
Разнообразие
- 2022
.
 Это исследование Isolased Образцы A. oChotense от BOTFEFFISH -Shorphyflichlog. и выполнили молекулярно-филогенетический анализ их ядерных областей 18S и 28S рДНК, который восстановил Anarhichotrema до Lissorchiidae, как первоначально предполагалось.
Это исследование Isolased Образцы A. oChotense от BOTFEFFISH -Shorphyflichlog. и выполнили молекулярно-филогенетический анализ их ядерных областей 18S и 28S рДНК, который восстановил Anarhichotrema до Lissorchiidae, как первоначально предполагалось.ГОДОВАЯ ИЗМЕНЧИВОСТЬ ПАРАЗИТОВ ACIPENSER RUTHENUS MARSIGLII В НИЖНИХ РЕКАХ ИРТЫША
- Воропаева Э., Либерман Э.
Биология
- 2020
Высказано предположение, что ежегодные изменения видового состава паразитов стерляди связаны с непосредственным влиянием температурного режима и колебаниями уровень бассейна Иртыша.
Молекулярная идентификация трематодных паразитов, заражающих пресноводных улиток Bithynia siamensis goniomphalos в Таиланде
Молекулярные данные использовались для улучшения идентификации и изучения разнообразия видов трематод, заражающих B. s.
S0031182022000051jra 622..639
- N.
 Wee, T. Cribb, S. Shirakashi, S. Cutmore
Wee, T. Cribb, S. Shirakashi, S. Cutmore Biology
- 2022
Genetic analyses of specimens from the Great Barrier Reef are consistent with the presence только из линии 1 H. longicollis, ареал которой включает как минимум Австралию и Японию, ареалы разделены более чем на 7000 км.
ПОКАЗАНЫ 1-10 ИЗ 56 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантностьНаиболее влиятельные документыНедавность
Исследования по дезорстису инфальте (Молин), ее истории жизни и сродства к трематодам семейства Acanthocolpidae
- R. M. Cable, A. V. Hunninen
Биология
- 1942
14. включают только формы, о которых известно или предполагается, что они имеют офтальмоксифидиоцеркарии, у которых главные экскреторные канальцы не достигают головной области тела до получения вторичных канальцев.
On the systematic position of the genus Deropristis, of Dihemistephanus sturionis little, 1930, and of a new digenetic trematode from a sturgeon
- R.
 M. Cable
M. Cable Biology
Parasitology
- 1952
The uncertain family position Deropristiinae обсуждается, не удаляя его из Lepocreadiidae, хотя независимый статус этого семейства может быть поставлен под сомнение в свете недавней работы.
Систематика Deropristiidae Cable & Hunninen, 1942 (Trematoda) и биогеографические ассоциации с осетровыми (Osteichthyes: Acipenseridae)
Предполагаются происхождение и распространение, связанные с формированием Североатлантического бассейна, а подтверждение морского происхождения Deropristiidae подтверждается биогеографией его сестринских таксонов и его хозяев, а также согласуется с атлантическим происхождением.
Род Skrjabinopsolus (Trematoda: Digenea) применительно к аллокреадиоидной проблеме.
- Л. Петерс
Биология
- 1961
В эмбриологии первичные экскреторные поры развиваются в хвосте церкарий на небольшом расстоянии от тела, что подтверждает выделение Skrjabinopsolus и родственных родов в отдельное семейство Deropristiidae.

Молекулярно-филогенетический анализ Microphalloidea Ward, 1901 (Trematoda: Digenea)
- В. Ткач, Д. Литтлвуд, П. Олсон, Дж. Кинселла, З. Свидерски
Биология
Систематическая паразитология
- 2004
Показано, что Microphalloidea, как представлено в настоящем наборе данных, состоит из трех основных клад, соответствующих семействам Lecithodendriidae, Microphallidae и Pleurogenidae + Prosthogonimidae.
Новый монорхиидный церкарий (Digenea), паразитирующий на пурпурном моллюске Amiantis purpurata (Bivalvia: Veneridae) в юго-западной части Атлантического океана, с примечаниями о его воздействии на гонады.
Безымянный микроцеркарий (Digenea: Monorchiidae), паразит Amiantis purpurata (Lamarck, 1818) (Bivalvia: Veneridae) и соответствующие ему метацеркарии из провинции Буэнос-Айрес…
Обновлены данные молекулярной филогенетики Opisthorchis spp. (Trematoda: Opisthorchioidea) от уток во Вьетнаме
- Т.
 Дао, Т. Нгуен, С. Габриэль, К. Буй, П. Дорни, Т. Ле
Дао, Т. Нгуен, С. Габриэль, К. Буй, П. Дорни, Т. Ле Биология
Паразиты и переносчики
10009 702
- 1
Печеночная двуустка от уток относится к Opisthorchis sp. BD2013», а также новые данные о последовательностях митохондриального (mt) генома и единицы ядерной рибосомной транскрипции, которые помогают в диагностике и уточнении таксономии видов описторхиид.
Филогенетический анализ подотряда plagiorchiata (Platyhelminthes, Digenea) на основе частичных последовательностей лсрДНК.
Филогения Lepocreadioidea (Platyhelminthes, Digenea), выведенная из ядерных и митохондриальных генов: значение для их систематики и эволюции
- R. Bray, A. Waeschenbach, T. Cribb, G. Weedall, P. Dyal, D. Littlewood
Биология
Acta Parasitologica
- 2009
Были оценены филогенетические отношения репрезентативных видов надсемейства Lepocreadioidea, но не удалось продемонстрировать, что значительная часть сайтов в гене nad1 развилась в результате положительного отбора; поэтому эта аномальная связь остается необъяснимой.


 Petkevičiūtė, V. Stunėnas, G. Stanevičiūtė
Petkevičiūtė, V. Stunėnas, G. Stanevičiūtė Это исследование Isolased Образцы A. oChotense от BOTFEFFISH -Shorphyflichlog. и выполнили молекулярно-филогенетический анализ их ядерных областей 18S и 28S рДНК, который восстановил Anarhichotrema до Lissorchiidae, как первоначально предполагалось.
Это исследование Isolased Образцы A. oChotense от BOTFEFFISH -Shorphyflichlog. и выполнили молекулярно-филогенетический анализ их ядерных областей 18S и 28S рДНК, который восстановил Anarhichotrema до Lissorchiidae, как первоначально предполагалось. Wee, T. Cribb, S. Shirakashi, S. Cutmore
Wee, T. Cribb, S. Shirakashi, S. Cutmore M. Cable
M. Cable
 Дао, Т. Нгуен, С. Габриэль, К. Буй, П. Дорни, Т. Ле
Дао, Т. Нгуен, С. Габриэль, К. Буй, П. Дорни, Т. Ле