Содержание
Ядовитые рыбы. Описания, особенности и названия ядовитых рыб
1. Первично ядовитые рыбы
1.1. Морские драконы
1.2. Хвостоколы
1.3. Морские крылатки
1.4. Морские окуни
1.5. Катран
1.6. Арабский хирург
2. Вторично ядовитые рыбы
2.1. Иглобрюхие
2.2. Морские угри
2.3. Скумбриевые
2.4. Стерлядь
Ядовитых рыб в мире около 600-от видов. Из них 350 активные. Таковым аппарат с токсином дан от рождения. Остальные рыбы вторично ядовитые. Токсичность таковых связана с питанием. Употребляя определенных рыб, рачков, моллюсков, вторичные виды накапливают их яд в определенных органах или всем теле.
Первично ядовитые рыбы
Ядовитые рыбы категории обладают продуцирующими токсин железами. В тела жертв яд попадает через укус, прокол специальными шипами или лучами плавников. Зачастую атаки направлены на обидчиков. То есть, эволюционно рыбы начали продуцировать яд для защиты.
То есть, эволюционно рыбы начали продуцировать яд для защиты.
Морские драконы
Ядовитые виды рыб включают 9 их наименований. Все обитают в водах умеренного климатического пояса и не превышают в длину 45-ти сантиметров. Относятся дракончики к окунеобразным.
Ядом у дракончиков наполнены шип на жаберной крышке и оси спинного плавника. Токсин является сложным белком. Он нарушает работу кровеносной и нервной систем. Такое же действие оказывает яд змей. По природе он схож с токсином морских дракончиков.
Для людей их яд не смертелен, однако вызывает сильную боль, жжение, приводит к отечности тканей. Мясо дракончиков съедобное, считается деликатесом.
Дракончики ядовитые представители Чёрного моря
Хвостоколы
Эти ядовитые рыбы моря являются скатами, то есть обладают уплощенными и крупными грудными плавниками. Они имеют форму ромба. Хвост ската всегда лишен плавника, но часто имеет игловидный вырост. Им-то и атакуют хвостоколы. Они, как и прочие скаты, являются ближайшими родственниками акул. Соответственно, хвостоколы не имеют скелета. Кости заменены хрящами.
Им-то и атакуют хвостоколы. Они, как и прочие скаты, являются ближайшими родственниками акул. Соответственно, хвостоколы не имеют скелета. Кости заменены хрящами.
Хвостоколов в морях 80 видов. Их токсичность отличается. Наиболее сильным ядом обладает синепятнистый скат.
Синепятнистый скат самый ядовитый из хвостоколовых
Один процент уколотых им людей погибают. Число пострадавших за год равно тысячам. На побережьях Северной Америки, к примеру, каждые 12 месяцев фиксируют минимум 7 сотен случаев нападения хвостоколов. Их яд оказывает нейротропное действие, поражая нервную систему. Токсин вызывает мгновенную, жгучую боль
Среди хвостоколов есть пресноводные. Один из видов обитает, к примеру, в Амазонке. Проживающие на ее берегах индейцы издревле делают из шипов рыб отравленные наконечники стрел, кинжалы, копья.
Морские крылатки
Относятся к семейству скорпеновых. Внешне крылаток отличают увеличенные грудные плавники. Они заходят за анальный, напоминая крылья. Еще крылатки отличаются выраженными иглами в спинном плавнике. Шипы есть и на голове рыб. В каждой игле — яд. Однако убрав шипы, крылаток, как и прочих скорпеновых, можно есть.
Еще крылатки отличаются выраженными иглами в спинном плавнике. Шипы есть и на голове рыб. В каждой игле — яд. Однако убрав шипы, крылаток, как и прочих скорпеновых, можно есть.
Эффектная внешность крылаток — повод для их аквариумного содержания. Любоваться рыбами дома позволяют также их небольшие размеры. Выбрать можно почти из 20-ти видов крылаток. Общее же число скорпеновых видов — 100. Крылатки в нем — один из родов.
Несмотря на ядовитость крылаток, их часто заводят в аквариумах из-за эффектного внешнего вида
Самая ядовитая рыба среди крылаток — бородавчатка. Иначе ее называют камнем. Имя связано с маскировкой бородавчатки под морские кораллы, губки. Рыба испещрена наростами, буграми, шипами. Последние ядовиты. Токсин приводит к параличу, но существует противоядие.
Если такового нет под рукой, место укола максимально нагревают, к примеру, опуская в горячую воду или подставляя под фен. Это снимает боль, частично разрушая белковую структуру яда.
Бородавчатка или рыба камень мастер маскировки
Морские окуни
Это род рыб. В нем 110 видов рыб. Все относятся к скорпеновым. Как и речные окуни, рыбы отличаются шипастыми спинными плавниками. Осей в них 13—15. Шипы есть и на жаберных крышках. В колючках — яд.
При уколе он попадает в рану вместе со слизью, которой покрыты жабры и плавники окуня. Токсин разносится по лимфатической системе, вызывая лимфаденит. Это увеличение лимфоузлов. Такова реакция иммунной системы на яд.
В месте укола шипами морского окуня быстро развиваются боль, отек. Однако токсин рыбы нестабилен, разрушается щелочами, ультрафиолетом и при нагреве. Особенно слаб яд окуней из Баренцева моря. Наиболее токсичны тихоокеанские особи. Если яд впрыснут несколько в одного человека, возможна остановка дыхания.
Морской окунь
Катран
Это ядовитый представитель акул. Весит хищник около 30-ти килограммов, в длину не превышает 2,2 метра.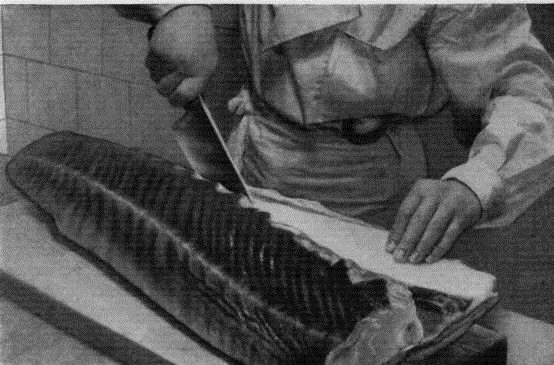 Встречается катран в Атлантике, а также вхож в ядовитые рыбы Черного моря.
Встречается катран в Атлантике, а также вхож в ядовитые рыбы Черного моря.
Токсин катрана является гетерогенным, то есть неоднородным, белком. Его продуцируют железы шипа, расположенного перед спинным плавником. Укол ведет к резкой боли, покраснению, ожогам. Зуд сохраняется несколько часов. Ожог сходит пару дней.
Катран представляет семейство колючих акул. Ядовитость других видов не доказана, но предполагается. Многих колючих акул сложно изучать. Черный вид, к примеру, глубинный, встречается в Атлантическом океане.
Катран единственный представитель акул, обитающих в Чёрном море
Арабский хирург
Представляет семейство хирурговых. Оно относится к отряду окунеобразных. Поэтому яд рыбы схож с токсином морских окуней, разрушается под воздействием жара. Однако внешность хирурга далека от облика сородичей.
Тело рыбы сильно уплощено с боков, высокое. Хвостовой плавник хирурга имеет форму полумесяца. Окраска разнится в зависимости от вида. Большинство хирургов пестрые, с яркими полосами и пятнами.
Окраска разнится в зависимости от вида. Большинство хирургов пестрые, с яркими полосами и пятнами.
В семействе хирурговых 80 видов рыб. У каждого под и над хвостом располагаются острые шипы. Они напоминают скальпели. С этим связано название рыб. Они редко превышают в длину 40 сантиметров, что позволяет содержать животных в аквариуме.
Арабский хирург — наиболее агрессивный представитель семейства, входит в ядовитые рыбы Красного моря. Там животное частенько нападает на дайверов, аквалангистов.
Хирургам рыба названа из-за брюшного плавника напоминающего скальпель
Вторично ядовитые рыбы
Вторично ядовитые рыбы накапливают сакситоксин. Это не белок, а алкалоид, относящийся к пуриновым соединениям. Яд содержат планктон динофлагеллят и многие моллюски. Они, как предполагается, получают токсин из одноклеточных водорослей, а те — из воды, накапливая вещество при определенных условиях.
Иглобрюхие
Это семейство рыб. Наиболее ядовитый его представитель — собака. Альтернативное название — фугу. Ядовитая рыба отличается укороченным телом, широкой, приплюснутой сверху спиной и широкой головой с клювообразным ртом.
Наиболее ядовитый его представитель — собака. Альтернативное название — фугу. Ядовитая рыба отличается укороченным телом, широкой, приплюснутой сверху спиной и широкой головой с клювообразным ртом.
В нем находятся 4 пластины сросшихся меж собой зубов. Ими фугу раскалывает панцири крабов и раковины моллюсков. Поедая последних, рыба получает токсин. Он смертельно опасен, накапливается в печени собаки.
Несмотря на ядовитость, фугу употребляют в пищу. Нужна подготовка рыбы, в частности, удаление печени, икры, кожи. Они пропитаны ядом. Блюдо популярно в Японии, с чем связаны некоторые эксцессы.
Так, в Гамагори, к примеру, зафиксирован случай реализации одним из местных супермаркетов 5-ти упаковок с цельной рыбой. Печень и икра не были удалены. Токсина в каждой рыбе достаточно, чтобы умерли 30 человек.
Фото ядовитых рыб часто представляет их в раздутом виде. На шар собака становится похожа в момент испуга. Фугу втягивает воду или воздух, в зависимости от среды нахождения. Увеличение в размерах должно отпугнуть хищников. С людьми «фокус» редко проходит.
Увеличение в размерах должно отпугнуть хищников. С людьми «фокус» редко проходит.
В момент испуга фугу раздувается, выставляя шипы
Морские угри
Эти ядовитые рыбы океана выбирают тропические воды, достигая там почти 3-х метров в длину. Иногда угри поедают моллюсков, которые поедают перидиний. Это жгутиконосцы. С ними связано явление красных приливов.
Из-за скопления рачков воды океана становятся красными. При этом многие рыбы гибнут, но угри адаптировались к яду. Он просто откладывается в коже, органах мурен.
Отравление мясом угря чревато зудом, онемением ног, языка, диареей и затрудненным глотанием. При этом во рту чувствуется привкус металла. Около 10% отравившихся парализует с последующим летальным исходом.
Морской угорь
Скумбриевые
К семейству относятся тунцы, макрель, ставриды, пеламида. Все они съедобны. Тунец считается деликатесом. В ядовитые рыбы мира скумбриевые «записываются», будучи несвежими. В мясе содержится гистидин.
В мясе содержится гистидин.
Это аминокислота. Она входит в состав многих белков. Когда рыба долго лежит в тепле, развиваются бактерии, преобразующие гистидин в заурин. Это гистаминоподобное вещество. Реакция организма на него схожа с сильной аллергией.
Определить отравленное мясо скумбриевых можно по острому, жгучему привкусу. Съев мясо, через несколько минут человек начинает мучиться от головной боли. Далее, пересыхает во рту, становится трудно глотать, сердце начинает учащенно биться. В финале на коже проступают красные полосы. Они зудят. Отравление сопровождается поносом.
Яд скумбриевых выражается в употреблении в пищу не свежее мясо рыбы
Стерлядь
Эта красная рыба ядовита за счет визиги — хорды из плотной ткани. Она заменяет позвоночник рыбы. Визига напоминает шнур. Его слагают хрящ и соединительная ткань. Сочетание безобидно, пока рыба свежая. Более того, визига портится быстрее мяса стерляди. Поэтому употреблять хрящ можно только в первые сутки после поимки рыбы.
Испортить трапезу может не только визига, но и лопнувший во время потрошения желчный пузырь стерляди. Содержимое органа придает мясу горький вкус. Возможно расстройство желудка.
Рыба стерлядь
При определенных условиях и питании ядовитыми становятся почти 300 видов рыб. Поэтому в медицине существует термин сигуатера. Им обозначают отравление рыбой. Особенно часто случаи сигуатеры фиксируются в прибрежных районах Тихого океана и в Вест-Индии.
Периодически в список несъедобных там попадают такие деликатесы, как: пятнистый групер, желтый каранкс, морской карась, японский анчоус, барракуда, рогатый кузовок.
Общее число рыб в мире превышает 20 тысяч видов. Шестьсот ядовитых из них кажутся малой толикой. Однако учитывая переменчивость вторично токсичных рыб и распространенность первично ядовитых, не стоит недооценивать видовую «узость» класса.
Стерлядь, фаршированная овощами и креветками
В старые времена стерлядь называли «царской рыбой», а монаршие особы, такие как Петр I и Иван Грозный, включали блюда из стерляди в свою трапезу. По велению Петра I эту рыбу даже начали разводить, чтобы не зависеть от ее поставщиков. И в настоящее время стерлядь остается уважаемой поварами и гурманами рыбой, из которой можно приготовить много изысканных деликатесов. Стерлядь, фаршированная овощами и креветками – одно из таких блюд.
По велению Петра I эту рыбу даже начали разводить, чтобы не зависеть от ее поставщиков. И в настоящее время стерлядь остается уважаемой поварами и гурманами рыбой, из которой можно приготовить много изысканных деликатесов. Стерлядь, фаршированная овощами и креветками – одно из таких блюд.
Ингредиенты для приготовления стерляди, фаршированный овощами и креветками:
Инвентарь:
Приготовления стерляди, фаршированный овощами и креветками:
Шаг 1: Готовим стерлядь
Прежде всего нам необходимо рыбу почистить и выпотрошить. Чистить стерлядь от чешуи, как это делают с речными рыбами, не требуется, не смотря на довольно жесткую кожу рыбы. У стерляди необходимо срезать наросты на коже (их называют «жучками»), которые расположены в ряд по бокам и на спине. Срезаем «жучки» на спине ножом, боковые счищаем, как чешую обычной рыбы – проводя ножом по коже от хвоста до головы.
Чистить стерлядь от чешуи, как это делают с речными рыбами, не требуется, не смотря на довольно жесткую кожу рыбы. У стерляди необходимо срезать наросты на коже (их называют «жучками»), которые расположены в ряд по бокам и на спине. Срезаем «жучки» на спине ножом, боковые счищаем, как чешую обычной рыбы – проводя ножом по коже от хвоста до головы.
Теперь стерлядь надо выпотрошить. Делаем надрез по брюшку вдоль всего тела от головы до хвоста и достаем внутренности. Последний нюанс – достать визигой. Визига – это белая длинная жила, которая находится в хрящевом позвоночнике стерляди. Для того, чтобы достать ее, нужно сделать надрез в позвоночнике, всунуть туда палец или вилку, подцепить визигой (она похожа на белу ленту) и аккуратно потянуть. Вынимать визигой следует осторожно, чтобы не порвать. Удалить визигой необходимо, так как рыба, приготовленная вместе с ней – несъедобна и даже ядовита.
После обработки стерлядь тщательно промываем под холодной проточной водой и вытираем насухо бумажным полотенцем или салфеткой.
Натираем стерлядь снаружи и изнутри солью и молотым перцем.
Шаг 2: Готовим креветки и овощи
Отвариваем креветки. Размораживать их перед варкой не нужно. Складываем креветки в дуршлаг и промываем холодной проточной водой, чтобы удалить лед и грязь. Бросаем креветки в кипящую подсоленную воду и варим 2,5-3 минуты, затем откидываем их в дуршлаг и даем воде стечь.
Отваренные креветки чистим от панциря. Для этого берем креветку за голову, переворачиваем брюшком вверх и аккуратно удаляем кавычки. После этого удаляем голову (просто тянем за нее) и стягиваем панцирь за хвост.
Сладкий перец моем, ошпариваем кипятком, удаляем плодоножки, вычищаем семена и режем полукольцами. В сковороду наливаем оливковое масло и слегка обжариваем перец.
Огурец моем в холодной воде, ошпариваем, нарезаем крупной соломкой и также обжариваем в оливковом масле, но отдельно от перца.
Лук очищаем от шелухи и нарезаем тонкими полукольцами.
Лимон моем, ошпариваем кипятком и нарезаем тонкими дольками.
Укроп и петрушку моем, ошпариваем и мелко рубим. Делим порубленную зелень на 2 части.
Смешиваем лук, лимон и одну часть зелени.
Сыр натираем на терке или разминаем вилкой и смешиваем с оставшейся зеленью и розмарином. Делим творог на 2 равные части.
Шаг 3: Фаршируем и запекаем стерлядь
Подготовленную стерлядь фаршируем овощами и креветками слоями: первый слой – сладкий перец, затем сыр с зеленью, креветки, снова сыр и огурец.
Раскладываем лист фольги на противень, посыпаем смесью лука с лимоном и зеленью. Выкладываем на фольгу стерлядь и также посыпаем ее луком и лимоном.
Заворачиваем стерлядь в фольгу и запекаем в духовке при температуре 200 градусов 40-50 минут.
Шаг 4: Подаем стерлядь, фаршированная овощами и креветками
Готовую рыбу разворачиваем, аккуратно перекладываем на блюдо и украшаем майонезом, лимоном, свежими овощами, креветками и оливками.
Приятного аппетита!
Советы:
— После того, как вы нафаршируете стерлядь, брюшко можно зашить толстой ниткой крупными стежками.
— Вместо лука с лимоном и зеленью стерлядь перед запеканием можно обмазать сметаной.
— К овощной начинке также можно добавить нарезанные кусочками шампиньоны.
Материал с сайта cookery.com.ua
Пожалуйста, оцените этот рецепт!
Ваша Оценка:
древних осетровых обладают эффективными механизмами репарации ДНК: влияние модельных генотоксикантов на развитие эмбрионов стерляди, Acipenser ruthenus
. 22 декабря 2020 г.; 22(1):6.
дои: 10.3390/ijms22010006.
Евгения Газо
1
, Роман Франек
1
, Радек Шинделка
2
, Евгения Лебеда
1
, Сахана Шивараму
1
, Мартин Пшеничка
1
, Кристоф Штайнбах
1
Принадлежности
- 1 Южночешский научно-исследовательский центр аквакультуры и биоразнообразия гидроценозов, Факультет рыболовства и охраны вод, Южночешский университет в Ческе-Будеёвице, Zátiší 728/II, 38925 Водняны, Чехия.

- 2 Лаборатория экспрессии генов, Институт биотехнологии-Биочев, Академия наук Чешской Республики, 252 50 Вестец, Чехия.
PMID:
33374934
PMCID:
PMC7792610
DOI:
10.3390/ijms22010006
Бесплатная статья ЧВК
Евгения Газо и др.
Int J Mol Sci.
.
Бесплатная статья ЧВК
. 22 декабря 2020 г.; 22(1):6.
дои: 10.3390/ijms22010006.
Авторы
Евгения Газо
1
, Роман Франек
1
, Радек Шинделка
2
, Евгений Лебеда
1
, Сахана Шивараму
1
, Мартин Пшеничка
1
, Кристоф Штайнбах
1
Принадлежности
- 1 Южночешский научно-исследовательский центр аквакультуры и биоразнообразия гидроценозов, Факультет рыболовства и охраны вод, Южночешский университет в Ческе-Будеёвице, Затиши 728/II, 389 25 Водняны, Чешская Республика.
- 2 Лаборатория экспрессии генов, Институт биотехнологии-Биочев, Академия наук Чешской Республики, 252 50 Вестец, Чехия.

PMID:
33374934
PMCID:
PMC7792610
DOI:
10.3390/ijms22010006
Абстрактный
Повреждение ДНК, вызванное экзогенными или эндогенными факторами, является общей проблемой для развивающихся эмбрионов рыб. Пути восстановления повреждений ДНК (DDR) помогают организмам свести к минимуму неблагоприятные последствия изменений ДНК. С точки зрения механизмов репарации ДНК осетровые представляют собой особенно интересную модель из-за их исключительной пластичности генома. Стерлядь ( Acipenser ruthenus ) — относительно мелкий вид осетровых. Цель настоящего исследования — оценка чувствительности эмбрионов стерляди к модельным генотоксикантам (камптотецину, этопозиду и бенз(а)пирену) и оценке реакции РДР. Мы оценили влияние генотоксикантов на выживаемость эмбрионов, скорость вылупления, фрагментацию ДНК, экспрессию генов и фосфорилирование киназы h3AX и ATM. Воздействие 1 мкМ бенз(а)пирена на эмбрионы стерляди вызывало низкий уровень повреждения ДНК, сопровождающееся фосфорилированием АТМ и 9Экспрессия гена 0101 xpc . И наоборот, воздействие этопозида в концентрации 20 мкМ вызывало повреждение ДНК без активации известных путей DDR. Эффекты 10 нМ камптотецина на развитие эмбриона были стадийно-специфичными, при этом ранние стадии, до гаструляции, были наиболее чувствительными. В целом, это исследование предоставляет фундаментальную информацию для будущего изучения путей DDR стерляди.
Мы оценили влияние генотоксикантов на выживаемость эмбрионов, скорость вылупления, фрагментацию ДНК, экспрессию генов и фосфорилирование киназы h3AX и ATM. Воздействие 1 мкМ бенз(а)пирена на эмбрионы стерляди вызывало низкий уровень повреждения ДНК, сопровождающееся фосфорилированием АТМ и 9Экспрессия гена 0101 xpc . И наоборот, воздействие этопозида в концентрации 20 мкМ вызывало повреждение ДНК без активации известных путей DDR. Эффекты 10 нМ камптотецина на развитие эмбриона были стадийно-специфичными, при этом ранние стадии, до гаструляции, были наиболее чувствительными. В целом, это исследование предоставляет фундаментальную информацию для будущего изучения путей DDR стерляди.
Ключевые слова:
банкомат; восстановление повреждений ДНК; h3AX; эмбрион; генотоксичность; осетр.
Заявление о конфликте интересов
w3.org/1998/Math/MathML» xmlns:p1=»http://pubmed.gov/pub-one»> Авторы заявляют об отсутствии конфликта интересов. Цифры
Рисунок 1
Жизнеспособность эмбрионов стерляди после воздействия…
Рисунок 1
Жизнеспособность эмбрионов стерляди после воздействия модельных генотоксикантов: ( A ) эмбрионы были…
фигура 1
Жизнеспособность эмбрионов стерляди после воздействия модельных генотоксикантов: ( A ) эмбрионы подвергались воздействию BaP и этопозида с 2 дня оплодотворения до 8 дня после оплодотворения; ( B ) эмбрионы подвергались воздействию камптотецина (CPT) с 2–24, 24–48 и 48–72 часов после оплодотворения; ( C ) эмбрионам вводили этопозид на стадии 1 клетки. Смертность эмбрионов отслеживали ежедневно в течение 8 дней. Результаты представляют собой среднее значение шести независимых экспериментов. Столбики погрешностей представляют собой стандартную ошибку среднего значения. Звездочки указывают на значительные различия по сравнению с контролем в тот же момент времени (* p < 0,05, критерий Краскела-Уоллиса).
Смертность эмбрионов отслеживали ежедневно в течение 8 дней. Результаты представляют собой среднее значение шести независимых экспериментов. Столбики погрешностей представляют собой стандартную ошибку среднего значения. Звездочки указывают на значительные различия по сравнению с контролем в тот же момент времени (* p < 0,05, критерий Краскела-Уоллиса).
Рисунок 2
Коэффициент вылупления эмбрионов стерляди после…
Рисунок 2
Коэффициент вылупления эмбрионов стерляди после воздействия БаП, этопозида и СРТ. Эмбрионов было…
фигура 2
Коэффициент вылупления эмбрионов стерляди после воздействия БаП, этопозида и СРТ. Эмбрионы подвергали воздействию БаП и этопозида от 2 до 8 часов после оплодотворения и СРТ от 2 до 24, 24–48 или 48–72 часов после оплодотворения. Результаты представляют собой среднее значение шести независимых экспериментов. Столбики погрешностей представляют собой стандартную ошибку среднего значения. Звездочки указывают на значительные различия по сравнению с контрольным значением в тот же момент времени (* p < 0,05, критерий Краскела-Уоллиса).
Результаты представляют собой среднее значение шести независимых экспериментов. Столбики погрешностей представляют собой стандартную ошибку среднего значения. Звездочки указывают на значительные различия по сравнению с контрольным значением в тот же момент времени (* p < 0,05, критерий Краскела-Уоллиса).
Рисунок 3
Фенотипы эмбрионов стерляди, наблюдаемые при…
Рисунок 3
Фенотипы зародышей стерляди, наблюдаемые через 8 дней после рождения: ( A ) контроль; ( Б…
Рисунок 3
Фенотипы зародышей стерляди, наблюдаемые на 8 dpf: ( А ) контроль; ( B ) этопозид 20 мкМ; ( C ) BaP 1 мкМ; ( D ) СРТ 10 нМ через 24–48 часов после оплодотворения; ( E ) CPT 10 нМ при 48–72 часах после оплодотворения. Изображения являются репрезентативными для большинства эмбрионов. Стрелка указывает на порок развития позвоночника (SM). Масштабная линейка 1 мм.
Изображения являются репрезентативными для большинства эмбрионов. Стрелка указывает на порок развития позвоночника (SM). Масштабная линейка 1 мм.
Рисунок 4
Процент ДНК в хвостах комет…
Рисунок 4
Процент ДНК в хвостах комет был проанализирован после воздействия 1 мкМ BaP, 20…
Рисунок 4
Процент ДНК в хвостах комет был проанализирован после воздействия 1 мкМ BaP, 20 мкМ этопозида (Et) или 10 нМ CPT. Эмбрионы непрерывно подвергались воздействию: ( A ) BaP и этопозида с момента оплодотворения до 8 dpf; ( B ) CPT на короткий срок при 2–24, 24–48 или 48–72 часах в секунду. Процентное содержание ДНК в хвостах комет анализировали у эмбрионов всех групп на 1–8 dpf. Результаты представляют собой среднее значение шести независимых экспериментов. Столбики погрешностей представляют собой стандартную ошибку среднего значения. Заглавные буквы указывают на значительное отличие от контроля на том же dpf (дисперсионный анализ (ANOVA), р < 0,05). Буквы нижнего регистра указывают на значительные различия между временными точками (dpf) для каждого лечения (ANOVA, p <0,05).
Столбики погрешностей представляют собой стандартную ошибку среднего значения. Заглавные буквы указывают на значительное отличие от контроля на том же dpf (дисперсионный анализ (ANOVA), р < 0,05). Буквы нижнего регистра указывают на значительные различия между временными точками (dpf) для каждого лечения (ANOVA, p <0,05).
Рисунок 5
Окрашивание ДНК в части…
Рисунок 5
Окрашивание ДНК в части плавника стерляди на 7 dpf. Крупный план…
Рисунок 5
Окрашивание ДНК
в части плавника стерляди на 7 дпф. Изображения крупным планом соответствуют квадратной области, показывающей аберрации ДНК. Изображения репрезентативны для большинства эмбрионов ( n = 10). Масштабные полосы соответствуют 50 мкм.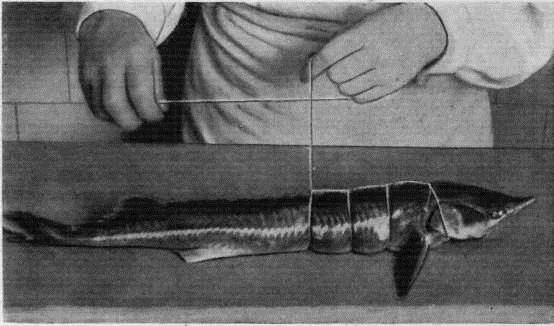
Рисунок 6
Вестерн-блоттинг анализ фосфо-h3AX…
Рисунок 6
Вестерн-блоттинг фосфо-h3AX (S139) (γ-h3AX) в белках, выделенных из эмбрионов стерляди…
Рисунок 6
Вестерн-блот-анализ фосфо-h3AX (S139) (γ-h3AX) в белках, выделенных из эмбрионов стерляди на 3 и 8 дпф. ( A ) Репрезентативные изображения вестерн-блоттинга, выполненные для шести различных культур. «С» — контроль; «CPT 24–48» — 10 нМ CPT через 24–48 часов после оплодотворения; «CPT 48–72» — 10 нМ CPT через 48–72 hpf; «В1» — 1 мкМ БаП; «Е20» – этопозид 20 мкМ. ( B ) Относительная интенсивность полос γ-h3AX на 3 dpf. ( C ) Относительная интенсивность полос γ-h3AX при 8 dpf. Значения выражены как средние ± SEM ( n = 6). Звездочки указывают на значительные различия по сравнению с контролем (критерий Крускала-Уоллиса, * p <0,1).
Звездочки указывают на значительные различия по сравнению с контролем (критерий Крускала-Уоллиса, * p <0,1).
Рисунок 7
Вестерн-блоттинг 53BP1…
Рисунок 7
Вестерн-блоттинг уровня белка 53BP1 у эмбрионов стерляди в возрасте 3 и…
Рисунок 7
Вестерн-блоттинг-анализ уровня белка 53BP1 в эмбрионах стерляди на 3 и 8 dpf. ( A ) Репрезентативные изображения вестерн-блоттинга, полученные для трех разных культур. «К» – контроль; «CPT 24–48» – 10 нМ CPT через 24–48 часов после оплодотворения; «CPT 48–72» — 10 нМ CPT через 48–72 hpf; «В1» — 1 мкМ БаП; «Е20» – этопозид 20 мкМ. ( B ) Относительная интенсивность полос 53BP1 при 3 dpf. ( C ) Относительная интенсивность полос 53BP1 при 8 dpf. Значения выражены как средние ± SEM ( n = 3). Звездочки указывают на значительные различия по сравнению с контролем (критерий Крускала-Уоллиса, * p <0,1).
Значения выражены как средние ± SEM ( n = 3). Звездочки указывают на значительные различия по сравнению с контролем (критерий Крускала-Уоллиса, * p <0,1).
Рисунок 8
Вестерн-блоттинг анализ фосфо-АТМ…
Рисунок 8
Вестерн-блот-анализ фосфо-АТМ (S1981) в белках, выделенных из эмбрионов стерляди при…
Рисунок 8
Вестерн-блот-анализ фосфо-АТМ (S1981) в белках, выделенных из эмбрионов стерляди на 3 и 8 дпф. ( A ) Репрезентативные изображения вестерн-блоттинга, выполненные для 3 разных культур. «С» — контроль; «CPT 24–48» — 10 нМ CPT через 24–48 часов после оплодотворения; «CPT 48–72» — 10 нМ CPT через 48–72 hpf; «В1» — 1 мкМ БаП; «Е20» – этопозид 20 мкМ. ( B ) Относительная интенсивность полос 53BP1 на 3 dpf. ( C ) Относительная интенсивность полос 53BP1 на 8 dpf. Значения выражены как средние ± SEM ( n = 3). Звездочки указывают на значительные различия по сравнению с контролем (критерий Крускала-Уоллиса, * p <0,1).
( C ) Относительная интенсивность полос 53BP1 на 8 dpf. Значения выражены как средние ± SEM ( n = 3). Звездочки указывают на значительные различия по сравнению с контролем (критерий Крускала-Уоллиса, * p <0,1).
Рисунок 9
Экспрессия мРНК генов, связанных с DDR…
Рисунок 9
Экспрессия мРНК генов, связанных с DDR, в 8 эмбрионах стерляди в дпф, измеренная методом количественной ПЦР.…
Рисунок 9
Экспрессия мРНК генов, связанных с DDR, в 8 dpf эмбрионах стерляди, измеренная с помощью количественной ПЦР. Эмбрионы непрерывно подвергались воздействию BaP и этопозида от оплодотворения до 8 dpf, а также CPT через 24–48 и 48–72 hpf. Результаты представлены как средние по крайней мере для четырех отдельных эмбрионов. Столбики погрешностей представляют собой стандартную ошибку среднего значения. Буквы указывают на значительные различия в экспрессии генов между различными видами лечения (критерий Крускала-Уоллиса, р < 0,1).
Столбики погрешностей представляют собой стандартную ошибку среднего значения. Буквы указывают на значительные различия в экспрессии генов между различными видами лечения (критерий Крускала-Уоллиса, р < 0,1).
Рисунок 10
Фрагментация ДНК эмбрионов стерляди…
Рисунок 10
Фрагментация ДНК эмбрионов стерляди, проанализированная методом кометного анализа. Примеры с кометы…
Рисунок 10
Анализ фрагментации ДНК
эмбрионов стерляди методом кометного анализа. Примеры из кометного анализа Эмбрионы Acipenser ruthenus , подвергнутые различным обработкам ( A ) контроль, ( B ) этопозид 20 мкМ, ( C ) СРТ 10 нМ, ( D ) СРТ 50 нМ. Относительные изменения фрагментации ДНК представлены увеличением количества ДНК в хвосте кометы.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Анализы транскриптома и протеома выявили стадийно-специфическую реакцию на повреждение ДНК у эмбрионов осетра (9).0401 Acipenser ruthenus ).
Газо И., Нараине Р., Лебеда И., Томчала А., Дитрих М., Франек Р., Пшеничка М., Шинделка Р.
Газо I и др.
Int J Mol Sci. 2022 7 июня; 23 (12): 6392. дои: 10.3390/ijms23126392.
Int J Mol Sci. 2022.PMID: 35742841
Бесплатная статья ЧВК.Влияние генотоксичных соединений на ДНК и развитие ранних и поздних стадий зародыша травяной креветки.
Ким ГБ, Ли РФ.
Ким ГБ и др.
Мар Энвайрон Рез. 2004 г., июнь; 57 (5): 329-38. doi: 10.1016/j.marenvres.2003.10.001.
Мар Энвайрон Рез. 2004.PMID: 14967517
Генотоксиканты индуцировали повреждение и репарацию ДНК на ранних и поздних стадиях развития эмбрионов травяной креветки Paleomonetes pugio, что было измерено с помощью кометного анализа.
Крюк ЮВ, Ли РФ.
Хук С.Э. и др.
Аква токсикол. 2004 г., 7 января; 66 (1): 1–14. doi: 10.1016/j.aquatox.2003.06.002.
Аква токсикол. 2004.PMID: 14687975
Стерилизация стерляди Acipenser ruthenus с помощью нокдаун-агента, антисмыслового морфолиноолигонуклеотида, против тупикового гена.
Линхартова З., Сайто Т., Кашпар В., Родина М., Прашкова Е., Хагихара С., Пшеничка М.
Линхартова З. и др.
Териогенология. 2015 15 октября;84(7):1246-1255.e1. doi: 10.1016/j.theriogenology. 2015.07.003. Epub 2015 11 июля.
2015.07.003. Epub 2015 11 июля.
Териогенология. 2015.PMID: 26248520
Мейотический гиногенез у севрюги, русского осетра и стерляди.
Рекубрацкий А.В., Грунина А.С., Барминцев В.А., Голованова Т.С., Чудинов О.С., Абрамова А.Б., Панченко Н.С., Купченко С.А.
Рекубрацкий А.В., и соавт.
Онтогенез. 2003 март-апрель;34(2):121-31.
Онтогенез. 2003.PMID: 12722590
Русский.
Посмотреть все похожие статьи
Цитируется
Анализы транскриптома и протеома выявили стадийно-специфическую реакцию на повреждение ДНК у эмбрионов осетра ( Acipenser ruthenus ).
Газо И., Нараине Р., Лебеда И., Томчала А., Дитрих М., Франек Р., Пшеничка М., Шинделка Р.

Газо I и др.
Int J Mol Sci. 2022 7 июня; 23 (12): 6392. дои: 10.3390/ijms23126392.
Int J Mol Sci. 2022.PMID: 35742841
Бесплатная статья ЧВК.
использованная литература
Таббс А., Нуссенцвейг А. Повреждение эндогенной ДНК как источник геномной нестабильности при раке. Клетка. 2017; 168: 644–656. doi: 10.1016/j.cell.2017.01.002.
—
DOI
—
ЧВК
—
пабмед
Эйзен Дж.
 А., Ханавальт П.К. Филогеномное исследование генов, белков и процессов репарации ДНК. Мутат. Рез. 1999; 435:171–213. doi: 10.1016/S0921-8777(99)00050-6.
А., Ханавальт П.К. Филогеномное исследование генов, белков и процессов репарации ДНК. Мутат. Рез. 1999; 435:171–213. doi: 10.1016/S0921-8777(99)00050-6.—
DOI
—
ЧВК
—
пабмед
Кинцлер А., Бони С., Дево А. Активность восстановления ДНК у рыб и интерес к экотоксикологии: обзор. Аква. Токсикол. 2013; 134–135:47–56. doi: 10.1016/j.aquatox.2013.03.005.
—
DOI
—
пабмед
Каюэла М.
 Л., Клаес К.Б.М., Феррейра М.Г., Энрикес С.М., ван Иден Ф., Варга М., Вирстрате Дж., Мионе М.К. Рыбка данио как новая модель для изучения повреждений ДНК при старении, раке и других заболеваниях. Фронт. Сотовый Дев. биол. 2018;6:178. doi: 10.3389/fcell.2018.00178.
Л., Клаес К.Б.М., Феррейра М.Г., Энрикес С.М., ван Иден Ф., Варга М., Вирстрате Дж., Мионе М.К. Рыбка данио как новая модель для изучения повреждений ДНК при старении, раке и других заболеваниях. Фронт. Сотовый Дев. биол. 2018;6:178. doi: 10.3389/fcell.2018.00178.—
DOI
—
ЧВК
—
пабмед
Podhorecka M., Skladanowski A., Bozko P. Фосфорилирование h3AX: его роль в реакции на повреждение ДНК и терапии рака. J. Нуклеиновые кислоты.




 2015.07.003. Epub 2015 11 июля.
2015.07.003. Epub 2015 11 июля.
 А., Ханавальт П.К. Филогеномное исследование генов, белков и процессов репарации ДНК. Мутат. Рез. 1999; 435:171–213. doi: 10.1016/S0921-8777(99)00050-6.
А., Ханавальт П.К. Филогеномное исследование генов, белков и процессов репарации ДНК. Мутат. Рез. 1999; 435:171–213. doi: 10.1016/S0921-8777(99)00050-6. Л., Клаес К.Б.М., Феррейра М.Г., Энрикес С.М., ван Иден Ф., Варга М., Вирстрате Дж., Мионе М.К. Рыбка данио как новая модель для изучения повреждений ДНК при старении, раке и других заболеваниях. Фронт. Сотовый Дев. биол. 2018;6:178. doi: 10.3389/fcell.2018.00178.
Л., Клаес К.Б.М., Феррейра М.Г., Энрикес С.М., ван Иден Ф., Варга М., Вирстрате Дж., Мионе М.К. Рыбка данио как новая модель для изучения повреждений ДНК при старении, раке и других заболеваниях. Фронт. Сотовый Дев. биол. 2018;6:178. doi: 10.3389/fcell.2018.00178.