Содержание
Стерлядь — определение термина
Термин и определение
пресноводный вид, обитает в реках бассейнов черного, каспийского, белого и карского морей, объект аквакультуры, максимальный размер и вес: 100-125 см, 16 кг, товарный (промысловый) размер и вес: 30-40 см, 1-2 кг, возраст половой зрелости: самцы созревают в возрасте 3-7 лет, самки — в 5- 12 лет, сроки нереста: апрель — июнь при оптимальной температуре воды 7-20 °c.
Еще термины по предмету «Водные биоресурсы и аквакультура»
Животные абиссальные
глубоководные животные.
Boдныe pecypcы
зaпacы пoвepxнocтныx и пoдзeмныx вoд paccмaтpивaeмoй тeppитopиeй.
Meтиoнин
нeзaмeнимaя aминoкиcлoтa.
Похожие
Биoмacca
Водовыпуски
Водолюбы
Дopcзaльный плaвник
Забракованная продукция
Индeкc зpeлocти pыб
Нижняя инфралитораль
Обесклеивание икры
Планктоихтиофаги
Погрузочный ордер
Пaнциpь
Пoликyльтypa
Пopкa
Пopoдa
Улов на единицу пополнения
Флeйтa
Эвглeнoвыe
Cпeктp питaния
Moтня
Pыбoлoвныe opyдия
Смотреть больше терминов
Научные статьи на тему «Стерлядь»
Ряд Осетрообразные
Представители:
белуга,
осётр,
севрюга,
стерлядь,
бистер — гибрид белуги и стерляди. ..
..
Стерлядь и лопатоносы живут в реках и озёрах. В основном приспособились к придонному образу жизни.
Статья от экспертов
Приведены данные по уловам стерляди в р. Волге, по сезонным изменениям возраста стерляди. Описано соотношение ходовых самок и самцов, совершающих нерестовую миграцию. Отмечено, что и ходовые, и покатные производители в уловах встречаются в течение всего сезона исследования. Это обстоятельство очень важно при организации лова производителей стерляди для рыбоводства. Заготовку стерляди для воспроизводства нужно проводить в течение всего сезона (апрель октябрь). Самки в р. Волге впервые нерестят…
Научный журнал
Creative Commons
Пример 1
Бистер (гибрид белуги и стерляди) унаследовал избранные качества своих родителей (вкусовые. ..
..
— от стерляди, большие размеры — от белуги).
Статья от экспертов
Изучена изменчивость длины рыла стерляди окской популяции. Проведен сравнительный анализ изменчивости этого признака у дикой и доместицированной окской стерляди. Показано, что длина рыла у окской стерляди зависит от возраста. Опровергнуто предположением о существовании двух рас окской стерляди длиннорылой и короткорылой.
Научный журнал
Creative Commons
Повышай знания с онлайн-тренажером от Автор24!
- 📝 Напиши термин
- ✍️ Выбери определение из предложенных или загрузи свое
- 🤝 Тренажер от Автор24 поможет тебе выучить термины, с помощью удобных и приятных
карточек
Возможность создать свои термины в разработке
Еще чуть-чуть и ты сможешь писать определения на платформе Автор24.
Укажи почту и мы пришлем уведомление с обновлением ☺️
Ясли для стерляди
В Самарской области на полуострове Копылово в 5 км ниже плотины Жигулевской ГЭС находится рыбоводное предприятие ПРВЗ-01Э, что означает плавучий рыбоводный завод, первый, экспериментальный. Директором завода является Елена Мороз. Она с удовольствием рассказала нам о своем судне и тонкостях выращивания молоди стерляди.
Плавучий рыбоводный завод был построен по решению властей после того, как на Волге возвели плотины для регулирования стока реки. Планировалось, что на каждом водохранилище для воспроизводства рыбных запасов будет существовать рыбоводное предприятие такого типа, чтобы плавучие инкубаторы можно было перемещать по Волге и выпускать мальков там, где это необходимо. Но задумкам не суждено было осуществиться, и плавучее рыбное царство осталось единственным и уникальным в своем роде на территории всей России.
ПРВЗ-01Э является несамоходной баржей. Данное предприятие – структурное предприятие Средне-Волжского филиала Федерального агентства по рыболовству ФГБУ «Главрыбвод». В задачи филиала входит сохранение и воспроизводство рыбных запасов в среднем течении реки Волги. В зону ответственности организации входит 7 регионов Российской Федерации: Самарская, Пензенская, Ульяновская области, республики Татарстан, Чувашия, Мордовия и Марий Эл. В соответствии с государственным заданием работники двух заводов – ПРВЗ-01Э и «Возрождение» – выращивают стерлядь и щуку и выпускают их в речные воды, когда мальки достигают определенного веса.
Данное предприятие – структурное предприятие Средне-Волжского филиала Федерального агентства по рыболовству ФГБУ «Главрыбвод». В задачи филиала входит сохранение и воспроизводство рыбных запасов в среднем течении реки Волги. В зону ответственности организации входит 7 регионов Российской Федерации: Самарская, Пензенская, Ульяновская области, республики Татарстан, Чувашия, Мордовия и Марий Эл. В соответствии с государственным заданием работники двух заводов – ПРВЗ-01Э и «Возрождение» – выращивают стерлядь и щуку и выпускают их в речные воды, когда мальки достигают определенного веса.
Плавучая баржа была получена учреждением в 1981 году и установлена на Саратовском водохранилище по левому берегу реки Волги в районе поселка Прибрежный в Куйбышевской области.
Через 6 лет, в октябре 1987 года, в связи с неблагополучной токсикологической обстановкой в данном месте завод был переведен несколько выше по течению Волги и расположился в небольшом заливе полуострова Копылово.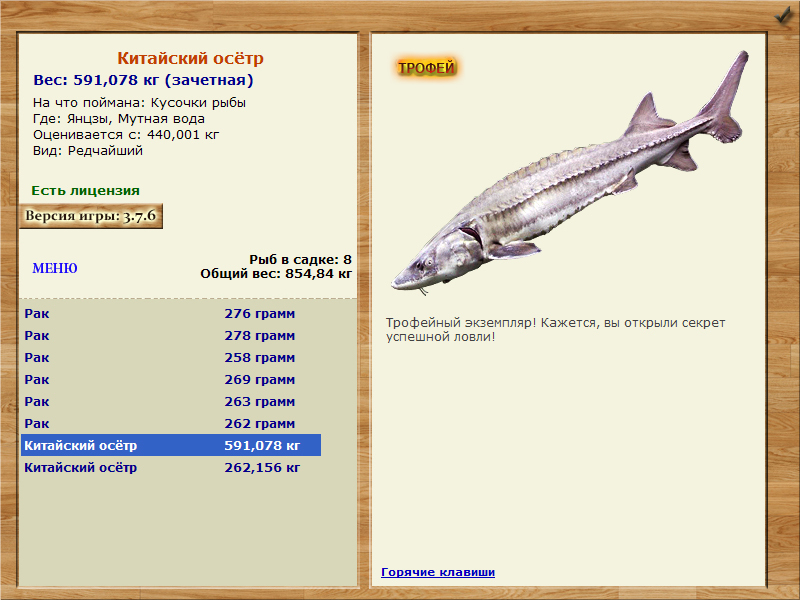 Здесь он находится уже более 30 лет.
Здесь он находится уже более 30 лет.
На судно можно попасть, преодолев подвесной мост. Трехпалубная баржа организована так, что все площади эффективно используются для выращивания молоди стерляди. Производственные помещения занимают почти две трети плавучего рыбного царства, среди них – инкубационно-вырастной цех и цех по выращиванию живых кормов для подрастающих мальков. Даже верхняя палуба используется рыбоводами по назначению, но так как стерлядь является донной рыбой и любит полумрак, то пришлось специально затемнить помещение от яркого солнечного света.
Для гармоничного роста молоди и ее последующей быстрой адаптации к естественным условиям рыбе необходима постоянная проточность воды в резервуарах. Полный водообмен происходит в течение часа. Забор воды для нужд завода производится непосредственно из Волги собственной насосной системой. После того, как вода поступает в специальную емкость в трюме, она проходит через очистные фильтры, насыщается кислородом и только после этого подается по трубопроводам к бассейнам с подрастающей рыбой.
Несмотря на свой солидный возраст, судно исправно справляется со своей задачей воспроизводства молоди стерляди. Поддерживают техническое состояние баржи 11 человек, среди которых есть и слесари-ремонтники, и мотористы, и энергетики. Всего на заводе работает 26 человек.
Стерлядь – единственный вид осетровых в Средневолжском бассейне, который может жить в пресноводной воде. Зарегулирование рек ухудшает условия воспроизводства стерляди. После постройки и запуска ГЭС естественное воспроизводство сильно сократилось из-за того, что многие нерестилища потеряли свое значение: какие-то места заилились, где-то поднялся уровень воды, водохранилище приобрело озерный вид и утеряло свое естественное течение. Все это повлияло на количество стерляди в наших водах. Численность особей уменьшилась настолько, что рыба была занесена в Красную книгу, а работники рыбозавода активно работают над тем, чтобы данный вид осетровых не исчез в Самарской области.
Выращивание мальков – трудоемкий и кропотливый труд. После получения живой оплодотворенной икры от половозрелых особей или же путем госзакупок икринки сначала в специальной установке обесклеиваются с помощью голубой глины в аппарате Орлова – барбатируются. В процессе барбатации в течение 50 минут икра находится во взвешенном состоянии, после чего промывается чистой водой. Это нужно для того, чтобы не образовался комок из икринок.
После получения живой оплодотворенной икры от половозрелых особей или же путем госзакупок икринки сначала в специальной установке обесклеиваются с помощью голубой глины в аппарате Орлова – барбатируются. В процессе барбатации в течение 50 минут икра находится во взвешенном состоянии, после чего промывается чистой водой. Это нужно для того, чтобы не образовался комок из икринок.
Далее полученная икра закладывается на инкубацию в аппараты «Осетр». Аппарат представляет собой специальный ящик, плавающий в воде. Икра помещается на сетчатое дно ящика, где она также постоянно омывается. Условия инкубации, таким образом, максимально приближены к естественным. Инкубация длится в зависимости от температуры воды от 6 до 10 дней – чем теплее вода, тем быстрее идет процесс.
После того, как икра проинкубируется, выклевывается личинка, переливается вместе с водой в желобок, отходящий от инкубационного ящика, и по нему поступает в специальный ящик – сортировщик, где личинки отделяются от оболочек. Чистые личинки попадают в бассейн-накопитель, из которого в дальнейшем эталонным методом малыши рассаживаются в емкости для последующего выращивания.
Чистые личинки попадают в бассейн-накопитель, из которого в дальнейшем эталонным методом малыши рассаживаются в емкости для последующего выращивания.
Елена Мороз рассказывает о технологии выращивания стерляди:
– Сначала мы помещаем порядка 15 тыс. штук личинок в один бассейн. Около недели они находятся в состоянии рассасывания желточного мешка. После того, как желточный мешочек рассосется, малыши начинают питаться. Как только молодь переходит на активное питание, мы рассаживаем ее дальше, где-то тысяч по пять в бассейн, чтобы рыбкам было не тесно. Наши рыбоводы пристально следят за мальками, чистят и промывают емкости, собирают отходы жизнедеятельности и остатки корма, чтобы соблюсти санитарное состояние воды, и наша рыбка была чистенькой и здоровенькой.
Кормят малышей специально выращенным на предприятии живым кормом, чтобы их нежная пищеварительная система начала правильно работать. В качестве корма используются науплии рачков Artemia salina. Взрослые рачки могут вырасти до размера в 8–10 миллиметров. Артемию используют как первоклассный высокопитательный корм для рыб. Она обладает высокой кормовой ценностью и способна повышать физиологические показатели животных.
Взрослые рачки могут вырасти до размера в 8–10 миллиметров. Артемию используют как первоклассный высокопитательный корм для рыб. Она обладает высокой кормовой ценностью и способна повышать физиологические показатели животных.
Рачков выводят в специальном аппарате, где их яйца находятся во взвешенном состоянии благодаря компрессору, подающему мелкодисперсный воздух и создающему бурление в воде. Вода обязательно должна быть соленой. Также для успешного развития артемии необходимо поддерживать температуру воды 28–30 градусов и обеспечить помещение достаточным количеством света. Перед выращиванием рачков яйца артемии декапсулируются, иначе они не выклюнутся. Декапсулирование происходит с помощью хлора, после чего яйца промываются водой в течение 3–5 часов и только потом помещаются в теплую соленую бурлящую воду. Инкубация длится от 1 до 1,5 суток. Размеры, до которых выращивают рачков, зависят от того, какого возраста рыба будет ими питаться. Чем взрослее малыши, тем дольше растят рачков.
Параллельно с живым кормом малькам начинают вводить и искусственный корм. В выростном цехе молодь живет в условиях, максимально приближенных к естественным, чтобы в дальнейшем, когда ее выпустят в открытый водоем, она не испытала сильного стресса и в кратчайшие сроки адаптировалась к условиям жизни в естественной среде. В бассейнах создается круговой ток воды, чтобы рыба умела сопротивляться течению. Малышей растят до достижения ими веса в 1,5 грамма, после чего их выпускают в речные воды.
Для выпуска стерляди в Волгу на предприятии существует специальная лодка с перфорированным дном – «прорезь», как называют ее работники завода. В днище у лодки проделаны специальные отверстия, из-за которых плавсредство наполовину заполнено водой.
Также очень важно не кормить готовое к выпуску поколение за 12 часов до часа Х. Это необходимо для того, чтобы стерлядь успела проголодаться и сразу после попадания в естественную среду обитания начала охотиться.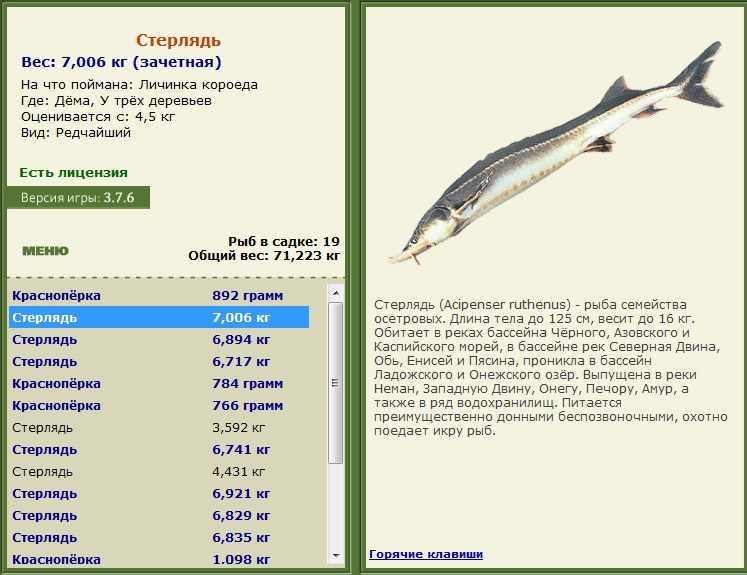
Перед тем как рыбу выпустить в Волгу, ее взвешивают и просчитывают среднештучную навеску в бассейне. Потом вместе с водой стерлядь помещается, а точнее, переливается в лодку-«прорезь». Теперь плавсредство вместе с рыбой буксируется на середину реки, на стрежень, и переворачивается. Таким образом рыба попадает из воды в воду.
Елена Мороз поясняет:
– Мы выращиваем именно стерлядь потому, что она отличается от остальных видов осетровых тем, что растет там, где родилась. Стерлядь совершает лишь небольшие передвижения, связанные или с сезонными изменениями гидрологического режима реки, или же с поисками пищи, нерестом и залеганием на зимовку. Она всегда находится в пределах нашего водохранилища.
Завод по воспроизводству стерляди работает круглогодично, но рыба выращивается сезонно в соответствии со своей активностью.
Директор завода рассказывает:
– С апреля мы начинаем отлавливать производителей, закладывать икру на инкубацию, а в конце июля – начале августа последние малыши покидают судно. После того, как госзадание выполнено, на судне начинаются ремонтные работы и подготовка к следующему весеннее-летнему сезону. У нас очень много двигателей, которые после завершения рыбоводного сезона нужно перебрать, почистить, смазать, провести профилактику. Весь рыбоводный инвентарь промывается, обрабатывается. Так, например, два года назад мы поменяли полностью систему водоснабжения. В этом году у нас планируется слипование судна – нашу баржу отгонят на судоремонтный завод, там ее поднимут из воды и отремонтируют подводную часть.
После того, как госзадание выполнено, на судне начинаются ремонтные работы и подготовка к следующему весеннее-летнему сезону. У нас очень много двигателей, которые после завершения рыбоводного сезона нужно перебрать, почистить, смазать, провести профилактику. Весь рыбоводный инвентарь промывается, обрабатывается. Так, например, два года назад мы поменяли полностью систему водоснабжения. В этом году у нас планируется слипование судна – нашу баржу отгонят на судоремонтный завод, там ее поднимут из воды и отремонтируют подводную часть.
В соответствии с государственным заданием предприятие выпускает 600 тыс. особей стерляди в год. Не так давно 350 тысяч подопечных покинули судно. Оставшиеся 250 тысяч мальков в эти дни отправились вслед за ними.
По словам Елены Мороз, им бы очень хотелось отслеживать эффективность их деятельности, но, к сожалению, в настоящее время нет контрольно-наблюдательных пунктов, которые могли бы отлавливать рыбу и проводить мониторинг. Однако, по рассказам любителей, рыбаков-добытчиков, мы знаем, что рыба в Волге появилась.
Однако, по рассказам любителей, рыбаков-добытчиков, мы знаем, что рыба в Волге появилась.
Говоря о планах на будущее, Елена Мороз поделилась с нами перспективами – предприятия ФГБУ «Главрыбвод» не будут изымать из водоема взрослых особей для получения половых продуктов, а также у них не будет необходимости закупать оплодотворенную икру. Это станет возможным благодаря еще одному заводу, входящему в состав Средне-Волжского филиала – рыбоводному предприятию «Возрождение» в селе Екатериновка, в паре с которым работает плавучий завод на полуострове Копылово. В Екатериновке выращивается два вида рыб – щука и стерлядь, и самое главное, здесь формируется свое маточное стадо осетровых, которое и будет использоваться для воспроизводства стерляди.
Стерлядь – рыба из семейства осетровых. Речная жилая донная рыба, приспособившаяся к существованию на участках с быстрым течением. Обычно стерлядь держится мелкими стайками или поодиночке, собираясь стаями в периоды нерестового хода и зимовок.Нерестится она в мае – начале июня, обычно в руслах верховий рек. Икра у стерляди клейкая, откладывается на каменисто-галечниковый грунт. Она развивается около 6–10 дней, постоянно омываясь водой. Взрослые, половозрелые особи обычно достигают длины 40–60 см и массы 0,5–2 кг, иногда встречаются экземпляры массой даже до 16 кг. В конце осени, в ноябре, рыба становится неактивной. Для того, чтобы перезимовать, стерлядь собирается на глубоких участках рек – зимовальных ямах, где проводит всю зиму в малоподвижном состоянии, не питаясь. Рыбы укладываются в ямах рядочком друг к другу, как поленница. Максимальная продолжительность жизни этих рыб – около 30 лет.
Наталья ТИЦ
Фото: Сергей СТАВЦЕВ
Рубрика:
Практикум.
Номер:
№ 7 (237).
Год:
2018.
Индукция спермации у стерляди Acipenser ruthenus путем доставки микрочастиц PLGA с устойчивым высвобождением аларелина
. 2021 19 ноября; 11 (11): 3305.
дои: 10.3390/ani11113305.
Питер Подгорец
1
, Йиндржишка Ноулз
1
, Якуб Выслоужил
2
, Сергия Борышполца
1
, Катерина Кубова
2
, Марек Родина
1
, Виталий Холодный
1
, Анатолий Сотников
1
, Дэвид Гела
1
, Борис Дзюба
1
Принадлежности
- 1 Южночешский научно-исследовательский центр аквакультуры и биоразнообразия гидроценозов, Факультет рыболовства и охраны вод, Южночешский университет в Ческе-Будеёвице, Затиши 728/II, 389 25 Водняны, Чешская Республика.

- 2 Кафедра фармацевтической технологии, фармацевтический факультет, Масариков университет, Палацкехо трида 1946/1, 612 00 Брно, Чехия.
PMID:
34828035
PMCID:
PMC8614542
DOI:
10.3390/ани11113305
Бесплатная статья ЧВК
Питер Подгорец и др.
Животные (Базель).
.
Бесплатная статья ЧВК
. 2021 19 ноября; 11 (11): 3305.
2021 19 ноября; 11 (11): 3305.
дои: 10.3390/ani11113305.
Авторы
Питер Подгорец
1
, Йиндржишка Ноулз
1
, Якуб Выслоужил
2
, Сергей Борышполец
1
, Катерина Кубова
2
, Марек Родина
1
, Виталий Холодный
1
, Анатолий Сотников
1
, Дэвид Гела
1
, Борис Дзюба
1
Принадлежности
- 1 Южночешский научно-исследовательский центр аквакультуры и биоразнообразия гидроценозов, Факультет рыболовства и охраны вод, Южночешский университет в Ческе-Будеёвице, Zátiší 728/II, 38925 Водняны, Чехия.

- 2 Кафедра фармацевтической технологии, фармацевтический факультет, Масариков университет, Палацкехо трида 1946/1, 612 00 Брно, Чехия.
PMID:
34828035
PMCID:
PMC8614542
DOI:
10.3390/ани11113305
Абстрактный
Обработку гипофиза карпа микрочастицами поли(молочной-со-гликолевой кислоты) с медленным высвобождением аларелина в дозе 35 мкг/кг -1 или 200 мкг/кг -1 массы тела для индукции спермиации сравнивали у стерляди Acipenser ruthenus . Все гормональные препараты изначально повышали уровень тестостерона и 11-кетотестостерона с последующим снижением уровня тестостерона, но неизменно высокими уровнями 11-кетотестостерона через 48 и 72 часа после лечения. Спермиация не отличалась между группами, получавшими гормоны, и не была обнаружена в контрольной группе, получавшей физиологический раствор. Введение гипофиза карпа привело к максимальному производству спермы через 24 часа после обработки, за которым последовало снижение через 48 часов после обработки, при этом через 72 часа сперматозоиды не были получены. Эффект Аларелина в дозе 35 мкг кг -1 массы тела и гипофиз карпа не отличались через 24 и 48 часов после обработки, тогда как 200 мкг/кг -1 массы тела аларелина ассоциировалось со значительно более низкой концентрацией сперматозоидов через 24 часа после обработки по сравнению с гипофизом карпа, без каких-либо различий в молочном объеме. Более высокая относительная продукция спермы наблюдалась через 48 часов после инъекции аларелина в дозе 200 мкг/кг -1 массы тела по сравнению с гипофизом карпа. Подвижность сперматозоидов была значительно выше у рыб, получавших аларелин в дозе 35 мкг/кг.0007 -1 м.
Спермиация не отличалась между группами, получавшими гормоны, и не была обнаружена в контрольной группе, получавшей физиологический раствор. Введение гипофиза карпа привело к максимальному производству спермы через 24 часа после обработки, за которым последовало снижение через 48 часов после обработки, при этом через 72 часа сперматозоиды не были получены. Эффект Аларелина в дозе 35 мкг кг -1 массы тела и гипофиз карпа не отличались через 24 и 48 часов после обработки, тогда как 200 мкг/кг -1 массы тела аларелина ассоциировалось со значительно более низкой концентрацией сперматозоидов через 24 часа после обработки по сравнению с гипофизом карпа, без каких-либо различий в молочном объеме. Более высокая относительная продукция спермы наблюдалась через 48 часов после инъекции аларелина в дозе 200 мкг/кг -1 массы тела по сравнению с гипофизом карпа. Подвижность сперматозоидов была значительно выше у рыб, получавших аларелин в дозе 35 мкг/кг.0007 -1 м. т. чем 200 мкг/кг -1 м.т. Лечение с оптимальным эффектом на индукцию спермиации представляло собой микрочастицы поли(молочно-гликолевой кислоты) с медленным высвобождением аларелина в дозе 35 мкг/кг -1 м.т.
т. чем 200 мкг/кг -1 м.т. Лечение с оптимальным эффектом на индукцию спермиации представляло собой микрочастицы поли(молочно-гликолевой кислоты) с медленным высвобождением аларелина в дозе 35 мкг/кг -1 м.т.
Ключевые слова:
воспроизведение; сперма; осетр; с замедленным выпуском.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Цифры
Рисунок 1
Кинетика высвобождения Аларелина из…
Рисунок 1
Кинетика высвобождения аларелина из микрочастиц PLGA.
фигура 1
Кинетика высвобождения аларелина из микрочастиц PLGA.
Рисунок 2
Концентрация тестостерона после гормонального лечения…
Рисунок 2
Концентрация тестостерона после гормонального лечения у стерляди. Достоверные различия между группами при…
фигура 2
Концентрация тестостерона после гормонального лечения у стерляди. Значительные различия между группами в точке отбора проб обозначаются строчными буквами ( р < 0,05). Значимые различия внутри экспериментальной группы в разное время после инъекции обозначены прописными буквами (множественные сравнения средних рангов для всех групп, p <0,05). * — указывает на достоверную попарную разницу между обработкой NaCl (контроль, доза 1 мл (0,9% NaCl)/кг) и каждой экспериментальной группой через 24 ч после инъекции (U-критерий Манна—Уитни, p < 0,05). Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг.
Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг.
Рисунок 3
Концентрация 11-КТ с и без…
Рисунок 3
Концентрация 11-КТ с обработкой гормонами и без нее у стерляди. Значительные различия между группами…
Рисунок 3
Концентрация 11-КТ с обработкой гормонами и без нее у стерляди. Значительные различия между группами в точке отбора проб обозначаются строчными буквами ( р < 0,05). Значимые различия внутри экспериментальной группы обозначены прописными буквами ( p < 0,05). Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг; NaCl — контроль, доза 1 мл (0,9% NaCl)/кг.
Рисунок 4
Объем молока после гормонального лечения.…
Рисунок 4
Объем молока после гормонального лечения. Значительные различия между группами в точке отбора проб…
Рисунок 4
Объем молока после гормонального лечения. Значимые различия между группами в точке выборки обозначены строчными буквами ( p < 0,05). Достоверные различия внутри экспериментальной группы обозначены прописными буквами ( p < 0,05). Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг.
Рисунок 5
Концентрация сперматозоидов после гормонального лечения. …
…
Рисунок 5
Концентрация сперматозоидов после гормонального лечения. Значительные различия между группами в точке отбора проб…
Рисунок 5
Концентрация сперматозоидов после гормонального лечения. Значимые различия между группами в точке отбора обозначаются строчными буквами ( р < 0,05). Достоверные различия внутри экспериментальной группы обозначены прописными буквами ( p < 0,05). Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг.
Рисунок 6
Относительная продукция сперматозоидов (RSP) после…
Рисунок 6
Относительная продукция сперматозоидов (RSP) после гормонального лечения. Достоверные различия между группами при…
Достоверные различия между группами при…
Рисунок 6
Относительная продукция сперматозоидов (RSP) после гормонального лечения. Значимые различия между группами в точке выборки обозначены строчными буквами ( p < 0,05). Достоверные различия внутри экспериментальной группы обозначены прописными буквами ( p < 0,05). * — указывает на значительную попарную разницу между группами, получавшими PLGA 200 через 24 ч, по сравнению с группами, получавшими PLGA200 через 48 и 72 ч после инъекции (U-критерий Манна—Уитни, р < 0,05). Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг.
Рисунок 7
Кинематические параметры сперматозоидов стерляди…
Рисунок 7
Кинематические параметры сперматозоидов стерляди, полученных после гормональной обработки. ( и ) ВКЛ…
( и ) ВКЛ…
Рисунок 7
Кинематические параметры сперматозоидов стерляди, полученных после гормональной обработки. ( a ) Динамика VCL после активации. ( b ) Динамика LIN после активации. Данные представлены в виде средних значений (точки) и линий квадратичной полиномиальной регрессии. Сокращения: КП 24 ч, КП 48 ч – обработка экстрактом гипофиза карпа в дозе 4 мг/кг, пробы отбирали через 24 и 48 ч после инъекции соответственно; PLGA 200 24 ч, PLGA 200 48 ч, PLGA 200 72 ч — обработка аларелином, доза 200 мкг/кг, пробы отбирали через 24, 48 и 72 ч после инъекции соответственно; PLGA 35 24 ч, PLGA 35 48 ч, PLGA 35 72 ч — обработка аларелином, доза 35 мкг/кг, образцы собраны через 24, 48 и 72 ч после инъекции соответственно.
Рисунок 8
Процент подвижности сперматозоидов (Подвижность, 10…
Рисунок 8
Процент подвижности сперматозоидов (Подвижность, 10 с после активации) образцов спермы стерляди, полученных после…
Рисунок 8
Процент подвижности сперматозоидов (Motility, 10 с после активации) образцов спермы стерляди, полученных после гормонального лечения в разное время после инъекции (24, 48 и 72 ч). Горизонтальные линии указывают на отсутствие значимого f-фактора «время после введения» (двусторонний дисперсионный анализ, р = 0,989). Разные буквы обозначают значительные различия между видами лечения разными гормонами, объединенными фактором «время после инъекции» (двусторонний ANOVA, p <0,001; апостериорный критерий Тьюки, p <0,05). Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг.
Горизонтальные линии указывают на отсутствие значимого f-фактора «время после введения» (двусторонний дисперсионный анализ, р = 0,989). Разные буквы обозначают значительные различия между видами лечения разными гормонами, объединенными фактором «время после инъекции» (двусторонний ANOVA, p <0,001; апостериорный критерий Тьюки, p <0,05). Опытные варианты: ЦП – экстракт гипофиза карпа, доза 4 мг/кг; PLGA35 — аларелин, доза 35 мкг/кг; PLGA200 — аларелин, доза 200 мкг/кг.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Влияние агониста гонадотропин-рилизинг-гормона, вводимого в виде микрочастиц, на качество и количество спермы, а также уровень половых стероидов в плазме у северной щуки.
Ноулз Дж., Борышполец С., Холодный В., Рахи Д., Выслужил Дж., Муселик Дж., Стейскал В.
 , Куржил Дж., Подгорец П.
, Куржил Дж., Подгорец П.
Ноулз Дж. и др.
Животное. 2022 Янв;16(1):100430. doi: 10.1016/j.animal.2021.100430. Epub 2021 24 декабря.
Животное. 2022.PMID: 34954552
Характеристики сперматозоидов и андрогены у Acipenser ruthenus после индукции спермиации экстрактом гипофиза карпа или имплантатами GnRHa.
Алави С.М.Х., Хатеф А., Милонас К.С., Гела Д., Пападаки М., Родина М., Кашпар В., Пшеничка М., Подгорец П., Линхарт О.
Алави С.М.Х. и др.
Рыба Физиол Биохим. 2012 Декабрь; 38 (6): 1655-1666. doi: 10.1007/s10695-012-9662-9. Epub 2012 5 июня.
Рыба Физиол Биохим. 2012.PMID: 22665160
Влияние температуры окружающей среды и гормональной стимуляции на созревание спермы in vitro у стерляди Acipenser ruthenus в преддверии нереста.

Дзюба В., Коссон Дж., Пападаки М., Милонас С.С., Штейнбах С., Родина М., Тучкова В., Линхарт О., Шелтон В.Л., Гела Д., Борышполец С., Дзюба Б.
Дзюба В, и др.
Животные (Базель). 2021 15 мая; 11 (5): 1417. дои: 10.3390/ани11051417.
Животные (Базель). 2021.PMID: 34063418
Бесплатная статья ЧВК.Ферментативная активность в энергообеспечении подвижности сперматозоидов двух таксономически далеких видов рыб (стерлядь Acipenser ruthenus, Acipenseriformes и сазан Cyprinus carpio, Cypriniformes).
Дзюба В., Дзюба Б., Коссон Дж., Родина М.
Дзюба В, и др.
Териогенология. 2016 март 1;85(4):567-74. doi: 10.1016/j.theriogenology.2015.090,040. Epub 2015 28 сентября.
Териогенология. 2016.PMID: 26483312
Исследовательский отчет NTP по основному исследованию CLARITY-BPA: перинатальное и хроническое исследование расширенного диапазона доз бисфенола А у крыс: исследовательский отчет 9 [Интернет].

Национальная программа токсикологии.
Национальная токсикологическая программа.
Research Triangle Park (Северная Каролина): Национальная программа токсикологии; 2018 сен.
Research Triangle Park (Северная Каролина): Национальная программа токсикологии; 2018 сен.PMID: 31305969
Бесплатные книги и документы.Обзор.
Посмотреть все похожие статьи
использованная литература
Бирштейн В.Дж., ДеСалль Р. Молекулярная филогения осетровых. Мол. Филогенет. Эвол. 1998; 9: 141–155. doi: 10.1006/mpev.1997.0443.
—
DOI
—
пабмед
Бронци П.
 , Розенталь Х., Гесснер Дж. Мировое производство аквакультуры осетровых: обзор. Дж. Заявл. Ихтиол. 2011;27:169–175. doi: 10.1111/j.1439-0426.2011.01757.x.
, Розенталь Х., Гесснер Дж. Мировое производство аквакультуры осетровых: обзор. Дж. Заявл. Ихтиол. 2011;27:169–175. doi: 10.1111/j.1439-0426.2011.01757.x.—
DOI
Подхорек П., Курил Дж. Индукция окончательного созревания ооцитов у карповых рыб гипоталамическими факторами: обзор. Вет. Мед. 2009 г.;54:97–110. doi: 10.17221/50/2009-ВЕТМЕД.
—
DOI
Алави С.М.Х., Хатеф А., Милонас К.С., Гела Д., Пападаки М., Родина М., Каспар В., Псеницка М., Подгорец П., Линхарт О.
 Характеристики спермы и андрогены у Acipenser ruthenus после индукции спермиации у карпа экстракт гипофиза или имплантаты GnRHa. Рыбы. Физиол. Биохим. 2012; 38:1655–1666. дои: 10.1007/s10695-012-9662-9.
Характеристики спермы и андрогены у Acipenser ruthenus после индукции спермиации у карпа экстракт гипофиза или имплантаты GnRHa. Рыбы. Физиол. Биохим. 2012; 38:1655–1666. дои: 10.1007/s10695-012-9662-9.—
DOI
—
пабмед
Ярон З., Богомольная А., Дрори С., Битон И., Айзен Дж., Куликовский З., Левави-Сиван Б. Индукция нереста у карпа: прошлый опыт и перспективы на будущее — обзор. Изр. Дж. Аквак.-Бамид. 2009 г.;61:5–26.
Грантовая поддержка
- NAZV QK1810221/Министерство сельского хозяйства Чехии
Характеристика роста и биохимического состава молоди стерляди Acipenser ruthenus L.
 из днестровской популяции, выращенной в РАН
из днестровской популяции, выращенной в РАН
Акимов И.А. 2009 г. — Красная книга Украины. Мир животных — Глобал Консалтинг, Киев, 600 с. (на украинском языке). Поиск в Google Scholar
Алимов С.И., Яковлева Т.В., Кулик П.В. 2007 — Восстановление осетра в Азовском море — Рыбохозяйственная наука Украины 2: 28-33 (укр.). Поиск в Google Scholar
Чипинов В.Г., Красильникова А.А., Коваленко М.В. 2012 — Сравнительная оценка применения полноценных сухих гранулятов европейского производства для кормления осетровых — Весник АГТУ 2: 99-104 (на русском языке). Поиск в Google Scholar
Folch H., Less M., Stanley H.A. 1957 г. — Простой метод выделения и очистки общих липидов из тканей животных — J. Biol. хим. 226: 497-499.10.1016/S0021-9258(18)64849-5Поиск в Google Scholar
Гоми М.Р., Никоо М., Сохрабнежанд М. 2013 — Влияние живой массы на состав тела и содержание жирных кислот выращиваемой белуги (Huso huso ) — междунар. Аква. Рез. 5: 6.10.1186/2008-6970-5-6Поиск в Google Scholar
Геснер Дж. , Фрейхоф Дж., Коттелат М. 2010 — Acipenser ruthenus — Красный список МСОП видов, находящихся под угрозой исчезновения. Версия 2014.3.
, Фрейхоф Дж., Коттелат М. 2010 — Acipenser ruthenus — Красный список МСОП видов, находящихся под угрозой исчезновения. Версия 2014.3.
Горский С.В., Яржомбек А.А. 2003 — Учебные материалы по рыбоводству: осетровые — Москва, Издательство ВНИРО, 74 с. (на русском языке). Поиск в Google Scholar
Худый О., Худа Л. 2014 — Распространение осетровых в бассейне Днестра — В: Актуальное состояние и сохранение естественной популяции осетровых рыб Acipenseridae (Ed.) R. Kolman, Wyd . IRS Olsztyn: 53-59 (на русском языке). Поиск в Google Scholar
Киреев П.О. 2011 — Сравнительный анализ физиологических показателей стерляди, выращенной в естественных и аквакультурных условиях — Рыбохозяйственная наука Украины 2: 47-54 (на русском языке). Поиск в Google Scholar
Колман Р. 2010 — Осетр: Разведение и выращивание. Руководство заводчика — Wyd. IRS, Ольштын, 134 стр. (на польском языке) Колман Р., Третьяк А. , Здановский Б., Дуда А., Вишневский Г., Прусинска М. 2011 — Разработка эффективных методов производства посадочного материала стерляди для восстановления истребленных популяций — В: Сохранение генетических ресурсов для восстановления популяций ценные виды рыб, Wyd. АСВ, Киев: 67-69. Поиск в Google Scholar
, Здановский Б., Дуда А., Вишневский Г., Прусинска М. 2011 — Разработка эффективных методов производства посадочного материала стерляди для восстановления истребленных популяций — В: Сохранение генетических ресурсов для восстановления популяций ценные виды рыб, Wyd. АСВ, Киев: 67-69. Поиск в Google Scholar
Колман Р., Капуста А., Щепковский М., Богацка-Капуста Е. 2014 — Атлантико-балтийский осетр (Acipenser oxyrinchus oxyrinchus Mitchill). Программа восстановления балтийского осетра в Польше — Wyd. IRS, Ольштын 94 р. (на польском языке). Поиск в Google Scholar
Копикова З., Вавреинова С. 2007 г. — Присутствие сквалена и холестерина в различных видах чешской пресноводной рыбы — Czech J. Food Sci. 25: 195-201.10.17221/733-CJFSПоиск в Google Scholar
Корчунов А.А., Металлов Г.Ф., Григорьев В.А. 2012 — Динамика биохимического состава тела и половых продуктов стерляди (Acipenser ruthenus L.), выращиваемой в замкнутых системах аквакультуры (УЗВ) — Рыбное Хозяйство. 1: 136-143 (на русском языке). Поиск в Google Scholar
Поиск в Google Scholar
Ли Д.Х., Лим С.Р., Ра К.С., Ким Дж.Д. 2012 — Влияние пищевого экстракта чеснока на состав аминокислот и жирных кислот всего организма, мышцы, профили свободных аминокислот и изменения в плазме крови у молоди стерляди, Acipenser ruthenus — Asian- Ауст. Дж. Аним. науч. 10: 1419-1429. Поиск в Google Scholar
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. 1951 г. — Измерение белка с помощью фолинофенольного реагента — J. Biol. хим. 193: 265-275.10.1016/S0021-9258(19)52451-6Поиск в Google Scholar
Любоевич Д., Трбович Д., Луйич Дж., Белич-Кабрило О., Костич Д., Новаков Н., Циркович М. 2013 — Жирнокислотный состав рыб внутренних вод — Bulg. Дж. Агрик. науч. Доп. 1: 62-71. Поиск в Google Scholar
Ovissipour M., Rasco B. 2011 — Профили жирных кислот и аминокислот домашней и дикой икры белуги (Huso huso) и влияние на коэффициент оплодотворения — J. Aquac. Рез. Разработка 2: 113.10.4172/2155-9546.1000113Поиск в Google Scholar
Пикич Э.
 Нерестится она в мае – начале июня, обычно в руслах верховий рек. Икра у стерляди клейкая, откладывается на каменисто-галечниковый грунт. Она развивается около 6–10 дней, постоянно омываясь водой. Взрослые, половозрелые особи обычно достигают длины 40–60 см и массы 0,5–2 кг, иногда встречаются экземпляры массой даже до 16 кг. В конце осени, в ноябре, рыба становится неактивной. Для того, чтобы перезимовать, стерлядь собирается на глубоких участках рек – зимовальных ямах, где проводит всю зиму в малоподвижном состоянии, не питаясь. Рыбы укладываются в ямах рядочком друг к другу, как поленница. Максимальная продолжительность жизни этих рыб – около 30 лет.
Нерестится она в мае – начале июня, обычно в руслах верховий рек. Икра у стерляди клейкая, откладывается на каменисто-галечниковый грунт. Она развивается около 6–10 дней, постоянно омываясь водой. Взрослые, половозрелые особи обычно достигают длины 40–60 см и массы 0,5–2 кг, иногда встречаются экземпляры массой даже до 16 кг. В конце осени, в ноябре, рыба становится неактивной. Для того, чтобы перезимовать, стерлядь собирается на глубоких участках рек – зимовальных ямах, где проводит всю зиму в малоподвижном состоянии, не питаясь. Рыбы укладываются в ямах рядочком друг к другу, как поленница. Максимальная продолжительность жизни этих рыб – около 30 лет.
 , Куржил Дж., Подгорец П.
, Куржил Дж., Подгорец П.
 , Розенталь Х., Гесснер Дж. Мировое производство аквакультуры осетровых: обзор. Дж. Заявл. Ихтиол. 2011;27:169–175. doi: 10.1111/j.1439-0426.2011.01757.x.
, Розенталь Х., Гесснер Дж. Мировое производство аквакультуры осетровых: обзор. Дж. Заявл. Ихтиол. 2011;27:169–175. doi: 10.1111/j.1439-0426.2011.01757.x. Характеристики спермы и андрогены у Acipenser ruthenus после индукции спермиации у карпа экстракт гипофиза или имплантаты GnRHa. Рыбы. Физиол. Биохим. 2012; 38:1655–1666. дои: 10.1007/s10695-012-9662-9.
Характеристики спермы и андрогены у Acipenser ruthenus после индукции спермиации у карпа экстракт гипофиза или имплантаты GnRHa. Рыбы. Физиол. Биохим. 2012; 38:1655–1666. дои: 10.1007/s10695-012-9662-9.