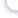Аквакультура В.И. КОЗЛОВ, А.Л. НИКИФОРОВ-НИКИШИН, А.Л. БОРОДИН. Ивтм инкубация икры
ИНКУБАЦИЯ ИКРЫ
ПодробностиПросмотров: 195
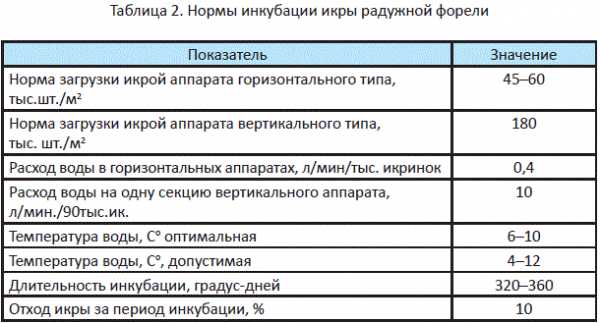
После того как икра набухнет, ее раскладывают на рыбоводные рамки ин- кубационных аппаратов. Рамки далее помещают в инкубационный аппарат. В аппарат нужно постоянно подавать воду температурой 6–12 °С. Развитие икры форели зависит более всего от температуры воды. Можно ориенти- ровочно считать, что развитие икры проходит в среднем за 320–360 граду- со-дней (при температуре воды 6 °С — 61 день, при 12°С— 26 дней и т.д.).
Бывают аппараты трех типов: (а) горизонтальные (б) вертикальные, (в) колбы с восходящим током воды (рис. 13). Выбор аппарата зависит от ряда причин: финансовые и организационные возможности, объем получаемого потом- ства, предпочтения рыбовода и др. Важно помнить, что ток воды должен быть постоянным. Лучше, чтобы вода текла за счет гравитации. В инкубационные аппараты подают холодную воду без взвесей. При необходимости воду про- пускают предварительно через механические фильтры. Во время инкубации следят постоянно за подачей воды, ее качеством и температурой.
В горизонтальных аппаратах икру помещают в рамки, плавающие в лотке. Аппарат имитирует ручей с проточной водой и расположенные на дне икринки. Важно поместить столько икринок, чтобы все икринки снабжались хорошей водой (т.е. икры поменьше), и чтобы рационально использовать простран- ство рамки (т.е. икры побольше). Исследования и опыт рыбоводов показывает, что на 1 м2 дна рамки можно размещать 45–60 тысяч икринок форели. К данному типу относятся аппараты Аткинса, Шустера, Вильямсона, калифорнийские, ропщинские.
Вертикальные аппараты более экономичные по использованию воды и пло- щади. В них рамки с икрой расположены в виде стеллажей друг над другом, а ток воды идет горизонтально по аппарату. На 1 м2 площади можно разместить до 600 тысяч икринок. Это аппараты Энвага, Риттай, Стеллажи, ИВТМ и ИМ.
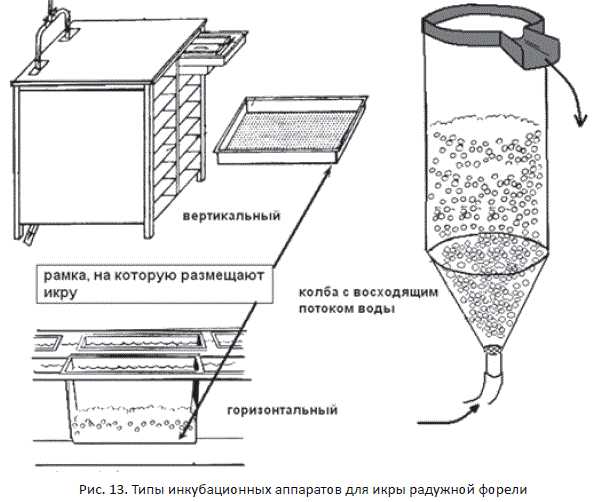
Рис. 13. Типы инкубационных аппаратов для икры радужной форели
Есть еще аппараты в виде колб с током воды (снизу вверх), в котором плавают икринки. Ток воды регулируют так, чтобы икринки не выносились с аппарата и не оседали на дне, а медленно перемешивались в нижней части аппарата. Объем воды в таких аппаратах — до 10 л. Типичным является аппарат Вейса (в западных странах известный как аппарат Зугера).
Закладка икры в инкубационные аппараты и их водоснабжение производят- ся в соответствии с инструкциями для каждого вида аппарата. При закладке икры в аппарат ее подсчитывают мерным (в трех пробах по 25 г с перерасче- том на все количество икры) или объемным способом (50 мл). Икру с помо- щью мерной емкости раскладывают в рамки: в горизонтальный аппарат — в 1–1,5 слоя (второй слой — неполный), в вертикальный аппарат — в 5–6 слоев.
Перед закладкой икры на инкубацию мертвые (побелевшие) икринки отбира- ют, используя пинцеты, грушу со стеклянной трубкой, сифон и др. инструменты (рис. 14). Далее постоянно отбирают мертвую икру в процессе инкубации. Мертвые икринки с одной стороны являются центром развития сапролегнии, с другой — при разложении тратят кислород, т.е. ухудшают качество воды в аппарате.

Рис. 14. Мертвые (побелевшие) икринки, которые надо отбирать вручную
Через 8–10 часов определяют оплодотворяемость икры по дроблению заро- дышевого диска и через 8–10 суток — по наличию развивающегося эмбри- она. Для этого небольшую порцию икры (50–100 шт.) из аппарата помеща- ют в 5% раствор уксусной кислоты с добавлением 5 г поваренной соли на 1 л раствора, при этом светлеет оболочка и сквозь нее видно тело эмбриона (если икра была оплодотворена) или просвечивает бесформенное утолще- ние (если икра не была оплодотворена).
На стадии пигментации глаз при значительном количестве мертвой икры применяют метод отбора путем погружения икры в 10%-ный раствор пова- ренной соли: мертвая икра всплывает (ее отбирают сачком), а живая — тонет. Оптимальная температура инкубации икры — 6–120С, содержание раство- ренного кислорода — не менее 7 мг/л, рН — 6,5–7,5. Расход воды — 40 л/ мин на 100 тысяч икринок в горизонтальных аппаратах, в вертикальных — 15 л/мин на 100 тысяч икринок.
Таблица 2. Нормы инкубации икры радужной форели
В связи с биологическими особенностями форели ее икру и свободные эм- брионы (предличинки) надо содержать в темноте. Для этого у горизонталь- ных аппаратов закрывают крышки, а отбор мертвой икры, промывку икры проводят при пониженном освещении. В случае вертикальных аппаратов или колб содержат в темноте зал, а все мероприятия проводят при помощи фона- риков со слабым светом, освещая только зону манипуляций.
losos.arktikfish.com
7.4. Получение половых продуктов и инкубация икры
ПодробностиПросмотров: 107
Сбор икры и спермы. Икру и сперму у производителей получают путем отцеживания с применением анестезирующих веществ. В качестве анестезирующих средств применяют соединения эфира, производные барбитуратовой кислоты, альдегидов, моноуридов, уретанов и др. Наиболее доступным и достаточно эффективным является хинальдин. Его применяют в концентрации 1:10 000 – 1:50 000. Раствор можно считать эффективным, если усыпление форели происходит в течение 1-2 мин и возвращение к нормальному состоянию – через 2-5 мин после помещения в проточную воду.
Раствор готовят следующим образом: 1 мл хинальдина разводят в 10-20 мл этилового спирта или ацетона и смесь заливают в емкость с 4-5 ведрами воды (45-50 л).
Икру отцеживают в сухой эмалированный или пластмассовый сосуд с марлевой салфеткой. В один сосуд собирают икру от 5-10 рыб с таким расчетом, чтобы икра занимала не более 2/3 емкости. Затем икру осеменяют спермой не менее 3 самцов, которую отцеживают непосредственно на икру или вначале в отдельные сухие стаканчики (бюксы), предварительно убедившись в ее хорошем качестве. Чтобы не задерживать процесс осеменения отцеживание икры и спермы следует проводить параллельно. При этом качество спермы у самцов может быть определено заранее, поскольку они созревают на 1-1,5 мес раньше, чем самки. При правильном содержании самцов доброкачественность спермы сохраняется в течение длительного времени. Время отцеживания икры и спермы до их смешивания не должно превышать 5-10 мин.
Икру и сперму осторожно, но тщательно перемешивают пучком перьев или рукой, затем приливают воду или оплодотворяющий раствор и сразу же перемешивают. В этот момент и происходит процесс оплодотворения- проникновение сперматозоида в икринку через микропиле .
В качестве оплодотворяющих растворов используют раствор Хамора, состоящий из 6 г хлористого натрия, 0,2 г хлористого кальция и 4,5 г мочевины, растворенных в 1 л чистой пресной воды. В Японии широко используют для этих целей физиологический раствор 0,85 %-ный раствор NaСl и оплодотворяющий раствор, содержащий 9,04 г/л NaCl, 0,24 г/л КС1 и 0,26 г/л СаС12), а также изотонический раствор NaCl с добавлением молока.
Оплодотворяющие растворы в несколько раз увеличивают подвижность сперматозоидов и время открытия микропиле, т.е. способствуют повышению степени оплодотворяемости икры. После добавления воды или оплодотворяющего раствора икру оставляют в покое на 3-5 мин и затем начинают отмывать от полостной жидкости, остатков спермы и органических примесей. Для этого периодически сливают воду после перемешивания икры и добавляют свежую воду. Воду приливают в сосуд по его стенкам, чтобы не подвергать нежную икру в начале эмбрионального развития механическим воздействиям. Отмывка длиться до тех пор, пока икра не станет чистой и икринки не будут прилипать к стенкам и дну сосуда. Прилипание икринок связано с усиленным всасыванием воды под оболочку икринки, то есть прохождением процесса набухания.
Кроме отцеживания производителей вручную существуют и другие способы получения половых продуктов, например при помощи воздуха. Для этого гиподермическую иглу соединяют с велосипедным насосом и вводят ее ниже брюшных плавников в полость тела самки. Туда постепенно нагнетают воздух, и созревшая икра свободно выходит через генитальное отверстие. После освобождения полости от икры воздух осторожно удаляют через трубку из тела путем отсасывания. Таким же методом получают и молоки, только трубку вводят в половое отверстие, и сперма поступает в пробирку.
Отмытую икру сливают в тазы и оставляют в них в течение 2-3 ч для завершения процесса ее набухания. При отсутствии проточной воды периодически (через 20-30 мин) заменяют воду в тазах. При наличии водопровода воду через резиновый шланг подают на дно емкости с икрой. Набухание икры следует проводить при рассеянном свете в затемненном помещении и в полном покое. В результате набухания объем икринки увеличивается на 15-20 %, а масса – на 16 %. Удобно проводить набухание в двойных тазиках, вкладываемых один в другой. Внутренний сосуд имеет перфорированное дно.
Если икра предназначена для перевозки в другие хозяйства, то период набухания должен быть увеличен до 2 ч.
Инкубация икры. Ее осуществляют в специальных инкубационных аппаратах, которые делят на 2 группы – горизонтального (лоткового) и вертикального типов.
У аппаратов горизонтального типа рамки с икрой расположены последовательно в горизонтальной плоскости, вертикального типа – в вертикальной плоскости. Наиболее распространенными в форелевых хозяйствах являются лотковые аппараты системы Аткинса, Шустера, Вильямсона, ропшинские и др.
В инкубационных аппаратах горизонтального типа на 1 м2 площади размещают до 45-60 тыс. икринок форели при расходе воды 20-40 л/мин на 100 тыс. икринок.
Аппарат Коста представляет собой ящик, который может изготовляться из дерева, глазированной глины, листового железа. На внутренней стороне ящика приблизительно на высоте 5 см от дна имеются выступы, на которые кладется деревянная рамка, обтянутая металлической сеткой с ячеей 18х3,5 мм. На рамке в один слой размещают икринки форели и лосося. Аппараты Коста обычно устанавливают на подставках в лестничном порядке в несколько групп. В каждую группу входят 4-6 аппаратов, снабжающихся водой от одного крана. Вода, поступающая в верхний аппарат, проходит над икрой и через сливной носик поступает в ниже расположенные аппараты. Рабочая емкость аппарата составляет 2-2,5 тыс. икринок, расход воды 0,6 л/мин. Аппарат прост в изготовлении и обслуживании. Недостаток в его малой мощности (рис.).
Аппарат Шустера (калифорнийский) состоит из двух ящиков, выполненных из листового железа. Наружный ящик (50 х30 х 18 см) имеет глухие стенки и дно. Внутренний ящик (40 х 29 х 12 см)имеет дно из металлической сетки с ячеей 18х3,5 мм. Он вставляется в наружный таким образом, чтобы его сливной носик вдвигался в сточный носик наружного ящика. Вода из крана поступает в наружный ящик (в промежуток 10 см между стенками ящиков), а затем снизу – во внутренний ящик, омывает на пути лежащие на сетчатом дне икринки и сбрасывается вверху через сливной носик. Аппараты Шустера, как и аппараты Коста, устанавливаются в лестничном порядке группами. В каждую группу входит не более 5 аппаратов. При расходе воды 2-3 л/мин на группу икра, лежащая в нижних аппаратах, обеспечивается необходимым количеством кислорода. Мощность составляет 5-6 тыс. икринок лосося, расход воды 1 л/мин (рис. ).
Иногда используют аппараты, размеры которых увеличены. Размеры наружного ящика в них составляют 100 х 60 х 18 см, а внутреннего – 80 х 58 х 12 см. Площадь аппарата увеличивается в четыре раза, а мощность достигает 20-24 тыс. икринок лосося.
Аппарат Рюккель-Вацека. Имеет нескколько больший размер сравнительно с аппаратом Шустера (56 х 45 х 19 см) и соответственно большую мощность по икре 20-40 тыс. икринок, а также круговую циркуляцию воды, которая создается благодаря наличию кроме сетчатого дна еще сетчатой и нижней части боковых стенок. Это позволяет лучше омывать икринки. Расход воды в аппарате составляет 4 л/мин. Применяется в Чехословакии и других западных странах (Купка, 1958; Костомаров, 1958).
Аппарат Аткинса. Представляет собой деревянный ящик размером 1,6 х 0,35 х 0,4 м. Конструктивно близок к лотковому аппарату. Икра инкубируется в 4 стопках, состоящих из 15-20 рамок размером 32 х 32 см каждая. Каждая рамка вмещает в один слой 2,5-3,0 тыс. икринок. В аппарат можно загружать до 200 тыс. икринок. У него две противоположные стороны бортиков каждой рамки сплощные, а две другие имеют вырезы перпендикулярно току воды. Расход воды в аппарате 12-15 л/мин (1-1,5 л/с на 1 млн. икринок). Пред вылуплением личинок для уменьшения их плотности часть рамок вынимают и помещают в запасные лотки (рис. ).
Аппарат Вильямсона представляет собой деревянный или бетонный желоб с 3-6 отделениями. Длина до 6 м, ширина 0,4 и высота 0,5 м. Перегородки, образующие отделение, установлены так, что одна из них, находящаяся ближе к притоку воды, не доходит до дна желоба на 5 см, а другая, находящаяся ближе к вытоку, наглухо закрывает дно желоба, но не доходит до верхнего края на 5 см. Таким образом, поступающая их крана в аппарат вода циркулирует в каждом отделении по вертикали (сверху вниз или снизу вверх) через рамки, равномерно омывая икринки, и сбрасывается через сливной носик. В каждое отделение помещают по 7 рамок. На каждую рамку размером 45 х55 см помещают в один слой 5 тыс. икринок лосося (рис. ). Нижняя рамка находится на расстоянии 6-7 см от дна.
У одной торцовой стенки происходит водоподача, у другой – сброс воды. У задней торцовой стенки помещается решетка, предохраняющая вынос икры. Икра инкубируется на рамках, уложенных стопками. Желоба можно устанавливать с зависимым водоснабжением, стыкуя их по два или по три с торцовых сторон. Мощность аппарата зависит от числа отделений и составляет 100-200 тыс. икринок. Расход воды с тремя отделениями 5-15 л/минн, с шестью – 10-30 л/мин. Обычно устанавливают спаренно.
Лотковый аппарат американского типа. Изготовляется преимущественно из дерева (рис.) Размер лотка 4,8 х 0,35 х 0,170 м (на наших заводах 3,0 х 0,5 х 0,25 м) с 4 рамками (700 х 350 и 600 х 495 мм). Одна рамка вмещает 8-19 тыс. икринок форели. Подача и сброс размещены в противоположных концах лотка. В 15 см от начала и конца лотка вставляют вертикальные предохранительные сетки с ячеей 2 мм. Расход воды в аппарате 6-8 л/мин .
Лотковый инкубационный аппарат шведского типа. Состоит из стеклопластикового лотка длиной 2240, шириной 490, высотой 215 и глубиной 165 мм. В инкубационном лотке устанавливают четыре инкубационных ящика размером 470х 470 мм, полезной площадью 0,14 м2 каждый. Инкубационный лоток площадью 0,84 м2 снабжен вертикальным уровенным стояком с верхним сливом воды и защитным экраном. Инкубационные ящики имеют перфорированное дно и наклонную стенку. Вода проходит через перфорированное дно, омывает икринки. а затем уходит через верхнюю перфорированную зону стенки ящика.
Каждый инкубационный ящик вмещает от 8,5 до 10,5 тыс икринок, а сам инкубационный лоток – от 34 до 42 тыс. икринок. В аппаратах такого типа удобно проводить все операции с икрой, а также выдерживать свободных эмбрионов и подращивать личинок до полного перехода на активное питание. Аппараты можно располагать один над другим спаренно (два сверху, два снизу). Расход воды составляет 0,005 л/с на 1 тыс. икринок или от 0,17 до 0,2 л/с на 1 инкубационный лоток.
Ропшинский лотковый аппарат простой в изготовлении, легкий в обслуживаниии, состоит из лотка размером 107 х 50 х 23,5 см. Лоток прикрывается крышкой. Икру размещают на 4 рамках , устанавливаемых одна над другой. В аппарат загружают до 20 тыс. икринок (по 5 тыс. шт. на каждую рамку. Аппараты устанавливают ступенчато в 2-3 яруса. Расход воды составляет 0,1-0,2 л/с (рис. ).
Аппараты вертикального типа. В настоящее время инкубационные аппараты вертикального типа приобрели большое распространение в промышленном рыбоводстве. Из аппаратов вертикального типа широко используются "Энваг", "Риттай", "Стеллажи", аппараты Вейса, ИВТМ и ИМ. Аппараты вертикального типа более экономичны по использованию воды, площади. и обьема инкубационного помещения. На 1 м2 инкубатора можно разместить до 600-1000 тыс. икринок. Расход воды можно уменьшить до 4-5 л/мин на 100 тыс. икринок.
Инкубационный аппарат ИВТ представляет собой затемненный двухсекционный шкаф этажерочного типа, внутри которого в специальных гнездах расположены собственные инкубационные аппараты – кюветы с рамками, которые опираются на роликоопоры. Каждая секция имеет независимую водоподачу. При извлечения любого аппарата водоснабжение не нарушается. Вода подается сверху, проходит последовательно через все секции аппарата и отводится в канализацию. Икра в ИВТ размещается на сетках рыбоводных рамок инкубационных аппаратов. В ИВТ предусматривается как инкубация икры, так и кратковременное выдерживание вылупившихся эмбрионов.
Инкубационный аппарат ИВТМ (модернизированный)
Инкубационный аппарат ИВТМ представляет собой двустворчатый шкаф, внутри которого в специальных гнездах на роликоопорах расположены собственно инкубационные аппараты – кюветы с рамками (рис.). Аппарат вмещает 2 стопки кювет по 7 шт. Норма загрузки в аппарат – 280 тыс. икринок. Размер кювета 600х 400х 80 мм, площадь ее 0,38 м2. Общий расход воды равен 6-10 л/мин. Общая масса аппарата 180 кг, габариты 750х 945х 1530 мм. Принцип тока воды в аппарате сохранен горизонтальный. Из приемной секции вода через перегородки поступает в камеру , затем поступает под рыбоводную рамку с икрой и, проходя через наклонную предохранительную сетку, стекает в сливной желоб, из него через каналы попадает в водоприемную камеру ниже расположенной кюветы. Для очистки и мойки кювета имеется специальное отверстие, После вылупления инкубационные рамки вынимают, некоторое время выдерживают личинок в кюветах, а затем пересаживают в бассейны.
Инкубационный аппарат ИМ (конструкции А.Н. Канидьева) состоит из трубчатой рамы-каркаса, в котором размещаются 10 емкостей для икры (по 5 шт. в каждой секции).Каждая емкость состоит из двух цилиндрических сосудов, вложенных один в другой. Внутренний сосуд, имеющий сетчатое дно из нержавеющей сетки с ячейками 2х 2 мм, предназначен для многослойного размещения инкубируемой икры форели или лосося. Сетчатое дно внутреннего сосуда отстоит на 1,5-2,0 см от основного днища внешнего сосуда. В центре последнего имеется жестко закрепленная уровенная труба, которая служит для сбора отработанной воды и подачи ее в нижележащую емкость. Для предохранения выноса личинок из аппарата на трубу надевают сетчатый колпак с ячеей 1,5-2 мм, диаметр которого на 1,5-2,0 см больше трубы (рис.).
Оплодотворенную и промытую икру размещают на сетчатом дне внутреннего сосуда вокруг водосливной трубы 10-15 слоями толщиной 6-8 см. Общее количество икры, входящее в 1 емкость, достигает 30 тыс. шт. икринок. Мощность аппарата 300 тыс. икринок. Для каждой вертикальной секции из 5 емкостей имеется свой водоподающий кран. Вода поступает на крышку емкости, стекает с нее и проходит между стенками емкостей, проходя снизу вверх через слой икры, сливается через оградительную сетку в трубу, из которой попадает уже на крышку нижележащей емкости. Из нижней, последней емкости вода поступает в поддон, а из него уходит в канализацию. Аппарат компактен, удобен в эксплуатации. Выдвижение каждой емкости из каркаса производят независимо от других и позволяет вести контроль за развивающейся икрой и проводить профилактическую обработку икры. Аппарат можно изготавливать из листового железа, стеклопластика или алюминия.
Установлено, что принципиально новая конструкция инкубационного аппарата, позволяющая имитировать естественные условия инкубации икры лососевых рыб в восходящих токах воды, как в нерестовых гнездах, дает возможность значительно снизить отход икры, уменьшить расход воды и производственную площадь в 6-10 раз и сократить трудовые затраты в 5 раз по сравнению с лотковыми аппаратами.
Инкубационный аппарат "Риттай" состоит из прямоугольных кювет ,расположенных одна над другой. Размер кювет 60 х 58 х 8,5 см. В каждой кювете имеется неглубокая сетчатая рамка, расположенная внутри нее. Дно приподнято на 1,5 см над основанием кюветы. Аппараты монтируют группами вертикально. Вода, питающая инкубационный аппарат, поступает в верхнюю кювету со стороны задней стенки, проходит через сетчатое дно внутренней рамки и омывает икру, затем переливается через ее переднюю стенку и отводится по каналу в заднюю часть аппарата, откуда поступает в расположенный ниже аппарат. Инкубационные аппараты "Риттай" размещают вертикально по 10 шт. в ряд. Каждый аппарат рассчитан на инкубацию 10 тыс. икринок кеты.
Вертикальный аппарат "Стеллажи", которые можно размещать в виде стеллажей или шкафов.
Аппарат Вейса. Предназначен для инкубации икры, в первую очередь, карпа и сигов, хотя в нем можно инкубировать обескленную икру судака, леща и щуки. Представляет собой цилиндр из стекла (оргстекла), сужающий с одной стороны на конус, в конце которого вставляется корковая или резиновая пробка. В центр пробки вставляется трубка, на которую надевается водоподающий шланг. В нем также можно успешно инкубировать икру лосося и форели, но предварительно несколько модернизировав. Модернизация заключается в размещении внутри сосуда круглой металлической решетки с ячеей 2-3 мм у основания конуса, что позволяет равномерно омывать икринки водой, создавать условия покоя,предохраняя их от механического воздействия. Иногда на сетку практикуют помещать слой мелкого гравия.
В один аппарат Вейса объемом 8 л можно загружать до 45 тыс икринок форели. Расход воды может составлять 30 мл/с в начале инкубации и до 50-100 мл/с в завершающий период. Подача воды должна быть отрегулирована так, чтобы икра находилась в спокойном состоянии.
Применение аппаратов емкостью до 80 л позволяет инкубировать в одном аппарате до 750 тыс. икринок. Оснащение цеха аппаратами Вейса увеличивает его производительность в несколько раз и существенно экономит площадь инкубационного цеха, занимаемую аппаратами.
Аппарат Орава представляет собой металлический ящик прямоугольного сечения со съемной передней стенкой, герметически прикрепляемой при помощи болтов. Дно аппарата изготовлено из досок толщиной 5 см; в 5 см от дна с внутренней стороны боковых стенок укреплены две полосы из углового железа – они служат опорой для рамок с икрой.
Вода в аппарат попадает через трубку, проходящую через центр дна. Для равномерного распределения воды трубка заканчивается Т-образным наконечником. Аппарат устанавливается на брусках сечением 40 х 40 х 30 мм. После укладки рамок с икрой, переднюю стенку герметически закрепляют, включая воду. Мощность аппарата 130 тыс. икринок. Недостатком является отсутствие постоянного визуального наблюдения за инкубируемой икрой.
Учет закладываемой на инкубацию икры проводят весовым и объемным способом. Более удобным является объемный способ. Икру мерной емкостью раскладывают на инкубационные рамки аппаратов горизонтального типа в 1-2 слоя, а в вертикальных – в 5-25 слоев. После размещения икры еще раз окончательно отбирают погибшие икринки, проводят профилактическую обработку икры купанием в растворе формалина в концентрации 1:2000 при экспозиции 10 мин или раствором хлорамина в концентрации 1:30 000 при экспозиции 10 мин.
Для отбора мертвой икры используют специальные рыбоводные пинцеты, груши со стеклянной трубкой с внутренним диаметром не менее 5-8 мм, сифоны и другие устройства различной конструкции.
В инкубационные аппараты должна постоянно поступать чистая, отстоянная (фильтрованная) вода требуемой температуры (6-120С), не содержащая взвесей, которые осаждаясь на икру затрудняют ее дыхание.
Если вода имеет большое количество взвесей, то следует дополнительно устанавливать ватно-марлевые фильтры, которые периодически по мере загрязннения меняют.
При подогреве воды ведут строгий контроль за содержанием свободного азота, насыщение которого в период инкубации не должно превышать 105 %.
В период инкубации следят за обеспечением непрерывной подачей воды и ее качеством. Осуществляют контроль за температурой воды. Еженедельно определяют содержание растворенного в воде кислорода и солевой состав воды. При накоплении взвешенных частиц на икре ее необходимо промывать под слабой струей воды (из лейки) на стадиях пониженной чувствительности к механическим воздействиям (табл 25). До стадии начала пигментации глаз промывание икры следует проводить только в случае крайней необходимости и с большой осторожностью
Таблица 25
Время наступления чувствительных стадий икры радужной форели при различной температуре воды, сут.
Стадия развития Температура воды, 0С
6810
Уплощение бластодиска 6 4 3
Начало гаструляции 7,5 5 4
Появление краевого узелка 12 7,5 4
Закрытие бластопора 16 11 9
Перед вылуплением 40 35 30
Таблица 26
Возможное время начала и окончания работ с икрой в период
инкубации, сут
Стадия развития
икры Температура воды, 0 С
6810
До утолщения бластодиска 1-5 1-3 1-2
Обрастание желтка бластодермой 13-15 8-10 6-8
Рост хвостового отдела и пигментация глаз 19-39 16-34 12-29
Весь период развития до вылупления 43-47 37-42 31-34
Инкубация икры должна проходить в темноте, поэтому инкубационные аппараты закрывают крышками, окрашивают в темный цвет, затемняют помещение. Все рыбоводные операции (отбор икры, промывка, загрузка и др.) должны проводиться при слабой освещенности.
В период инкубации проверяют оплодотворяемость икры. Оплодотворенную икру от неоплодотворенной можно отличить на стадии дробления зародышевого диска, т.е. на 1-3 сут после оплодотворения. Неоплодотворенная икра имеет расплывчатый плоский зародышевый диск, неясно выраженные борозды дробления. Можно на стадии, характеризующейся началом пульсации сердца и обособления хвостовой части зародыша (через 90 – 110 градусо-дней при оптимальной температуре)
Продолжительность инкубации икры находится в прямой зависимости от температуры воды: 101 день при 3,20С, 75 – 4,8, 44 – 7,5, 29 – 10,3, 27 – 11,5, 25 – 12, 21 – 14,5 и 18 дней при 15,50С.
Для этого пробу икры помещают в 5 % -ный раствор уксусной кислоты с добавлением 7 г поваренной соли на 1 л раствора. В этом растворе оболочка икры обесцвечивается и в нормально оплодотворенной и развивающейся икре становится хорошо заметной белая полоска тела зародыша. Для этих же целей можно использовать жидкость Буэна или 10,7 %-ный раствор NaCl ( 960 г NaCl на 8 л воды), в котором неполноценная икра осаждается в течение 3 мин. Можно помещать икру в 12 %-ный солевой раствор, при этом погибшая икра всплывает, а живая остается на дне сосуда.
Для предупреждения поражения икры сапролегнией необходимо в процессе инкубации проводить периодические профилактические ванны в течение 10 мин формалином (1:2000), хлорамином (1:30 000) или малахитовым зеленым (1:150 000). Обрабатывать икру следует на второй день после закладки ее на инкубацию, а с момента начала пигментации глаз – 1-2 раза в неделю. Хорошо зарекомендовал себя метод обеззараживания воды с помощью бактерицидных установок, особенно при оборотном и циркуляционном использовании воды.
В период инкубации икры ведут ее учет, занося данные в журнал, где регистрируют количество инкубируемой икры, дату закладки на инкубацию, отходы, начало и массовое вылупление и его завершение, профилактические мероприятия, температуру воды, содержание растворенного в воде кислорода и другие сведения о ходе инкубации.
Анализ результатов инкубации (на основании многолетних данных) позволяет надежно планировать производственный процесс.
biblio.arktikfish.com
ИНКУБАЦИЯ ИКРЫ
ПодробностиПросмотров: 103
Инкубацию икры осуществляют в специальных инкубационных аппаратах, которые делят на 2 группы - горизонтального и вертикального типов. У аппаратов первой группы рамки с икрой располагаются последовательно в горизонтальной плоскости, а у второй - в верти-кальной.
Наиболее распространенными в форелевых хозяйствах являются лотковые аппа-раты системы Аткинса, Шустера, Вильямсона, калифорнийские, ропшинские и другие.
В инкубационных аппаратах горизонтального типа на 1 м можно разместить до 45-60 тыс. икринок форели, расход воды составляет 20-40 л/мин., на 100 тыс. икринок.
Из аппаратов вертикального типа широко используются "Энванг", "Риттай", "Стеллажи", аппараты Вейса, ИВТМ и ИМ. Аппараты вертикального типа более экономичны по ис-пользованию воды и площади-на 1 м2 инкубатора можно разместить до 600-1000 тыс. ик-ринок, расход воды снизить до 4-5 л/мин., на 100 тыс. икринок.
Икру мерной емкостью раскладывают на сетчатые рамки инкубационных аппаратов в 1-1,5 слоя, вертикальные - в 1,5-2,0 слоя, в многослойном ИМ-в 12 слоев. Перед закладкой икру на инкубацию определяют ее количество весовым или объемным способом, отбира-ют погибшие икринки, проводят профилактическую обработку раствором формалина в концентрации 1 :2000, при экспозиции 10 мин. или раствором хлорамина в концентрации 1 : 30000 при экспозиции 10 мин. Для отбора мертвой икры используют специальные пин-цеты, груши со стеклянной трубкой с внутренним диаметром не менее 5 мм, сифон и дру-гие устройства. В инкубационные аппараты должна поступать чистая вода, не содержащая взвесей (табл. 73).
Таблица 73
Характеристика воды, поступающей в инкубационный форелевый цех
Показатель Значение
Температура воды для инкубации икры форели, °С
Для подращивания личинок форели
Прозрачность, м
Взвешенные вещества, мг/л
Водородный показатель, (рН)
Кислород растворенный, мг/л
Процент насыщения
Сероводород, мг/л
Свободная двуокись углерода, мг/л
Окисляемость перманганатная, мгО2/л
БПК5, мгО2/л
БПКПОЛН, мгО2/л
Азот аммонийный, мг/л
Аммиак свободный, мг/л
Железо:
общее, мг/л
закисное, мг/л
Жесткость, мг экв./л
Минерализация, г/м3 6-10
12-15
не менее 2,0
до 5
7-8
9,0-11,0
100 ±5,0
отсутствие
не более 10,0
не более 10,0
до 2,0
до 3,0
до 0,75
до 0,01
до 0,1
отсутствие
3-10(1,5-5,0)
до 1,0(1000)
Чтобы очистить воду от взвешенных веществ, ее нужно отстаивать или фильтровать. Если вода имеет большое количество взвесей, то можно устанавливать дополнительные ватно-марлевые фильтры, которые подвешивают на водоподающие краны.
В период инкубации следят за регулярной подачей воды, ее качеством. Контролируют температуру воды, еженедельно определяют содержание растворенного в воде кислорода и солевой состав. При наличии взвешенных частиц на икре ее промывают под струей (лейкой) на стадиях пониженной чувствительности к механическим воздействием (табл. 74).
Таблица 74
Время наступления чувствительных стадий икры радужной форели
при различной температуре воды, сутки
Стадия развития Температура воды, °С
6810
Уплощение бластодиска - бластула
Начало гаструляции
Появление краевого узелка
Закрытие бластопора
Перед вылуплением 6
7,5
12
14
40 4
5
7,5
11
35 3
4
4
9
30
До начала пигментации глаз промывание икры следует проводить только в случае крайней
необходимости и с большой осторожностью.
Инкубация икры должна проходить в темноте, поэтому инкубационные аппараты закры-вают крышками, окрашивают в темный цвет, затемняют помещение. Все рыбоводные операции (отбор икры, промывка, загрузка и др.) должны проводиться при слабой осве-щенности.
В период инкубации проверяют оплодотворяемость икры. Оплодотворенную икру от не-оплодотворенной можно отличить на стадии дробления зародышевого диска, т. е. на 1-3 сутки после оплодотворения. Пробу, включающую 100 икринок, фиксируют в 10 % рас-творе формалина, затем срезают бластодиск с участком желтка и размещают на предмет-ном стекле. Под бинокулярным микроскопом у оплодотворенной икры можно увидеть четкие и правильно выраженные борозды дробления. Неоплодотворенная икра имеет рас-плывчатый плоский зародышевый диск, неясно выраженные борозды дробления. Оплодо-творенность икры и ход эмбриогенеза можно установить на стадии, характеризующейся началом пульсации сердца и обособления задней части зародыша (через 90-110 градусод-ней при оптимальной температуре). Пробу икры помещать в 10 %-ный раствор уксусной кислоты с добавлением 10 г поваренной соли на 1 л раствора. В этом растворе оболочка икры обесцвечивается и в нормально оплодотворенной и развивающейся икре становится хорошо заметной белая полоска тела зародыша. Для этих же целей можно использовать жидкость Буэна, или 10,7 %-ный раствор NaCl (960 г NaCl на 8 л воды), в котором неоп-лодотворенная и неразвивающаяся икра осаждается в течение 3 мин. Можно икру поме-щать в 12 %-ный солевой раствор, при этом погибшая икра всплывает, а живая опустится. Для предупреждения поражения икры сапролегнией необходимо в процессе инкубации проводить периодические профилактические ванны в течение 10 мин. формалином (1 :2000), хлорамином (1 : 30000) или малахитовым зеленым (1 : 50000). Обрабатывать икру следует на второй день после закладки на инкубацию, а затем, с момента начала пигмен-тации глаз, 1-2 раза в неделю. Хорошо зарекомендовал себя метод обеззараживания воды с помощью бактерицидных установок, особенно при оборотном и циркуляционном ис-пользовании воды.
В период инкубации икры в специальном журнале регистрируется количество инкубируе-мой икры, дата закладки на инкубацию, отходы, начало и массовый выклев и его заверше-ние, профилактические мероприятия, температура воды, содержание растворенного в воде кислорода и другие сведения о ходе инкубации. Анализ результатов инкубации позволяет, по многолетним данным, планировать производственный процесс.
biblio.arktikfish.com
8.2. Сбор и инкубация икры
Массовое созревание самок наблюдается в первой половине декабря при температуре воды 0,2-0,30С. Икру получают в помещении. Инкубация продолжается всю зиму до 6 мес. Только баунтовские сиги мечут икру по льдом в конце марта- начале апреля. Пелядь речная созревает перед ледоставом в октябре при 20С и ниже, озерная форма – конце ноября-декабре при 0,2-0,80С. Европейская и сибирская ряпушки, муксун, чир, сиг лудога, чудской, пыжьян нерестуют в момент ледостава. При этом чир выметывает икру только в проточной воде.
Сроки нереста в условиях рыбоводных хозяйств-воспроизводственных комплексов зависят от климатических факторов и условий нагула в преднерестовый период. Методика получения, осеменения и оплодотворения икры сиговых разработана и хорошо освоена (Яндовская, Гальнбек, 1959; Кугаевская, 1968).
Икру и сперму берут только от производителей с текучими половыми продуктами, которые выделяются уже при слабом нажатии на брющко. Не берут икру, среди которой встречаются светло-серого и белого цвета икринки
В один таз отцеживают икру от 2-3 самок и добавляют сперму от 3-4 самцов, затем икру тщательно перемешивают и оставяют в покое 4-5 мин, затем добавляют еще воды и вновь перемешивают. После этого приступают к промывке и обесклеиванию икры в большом объеме воды, сменяя воду 20-30 раз. Процесс набухания у сиговых протекает в спокойном состоянии на протяжении 1,5-6 ч. Конечная прочность оболочки икры наступает через 7-14 ч, слой воды в тазу снабухающей икрой сотавляет 15-20 см. Воду меняют через 30-40 мин. Объем икры в период набухания увеличивается на 150 %.
Оплодотворенную и освобожденную от клейкости икру после набухания при необходимости перевозки загружают на рамки, которые стопкой устанавливают в специальных транспортировочных ящиках. Длительность транспортировки в первые 2 дня после оплодотворения не должна превышать 12 ч. На стадии морулы икру можно перевозить в течение 2-3 суток, т. е. на 3-5 сутки при температуре 2-50С. Икра в этот период более устойчива к колебаниям температурного и кислородного режимов. Перевозка икры должна быть закончена в конце стадии дробления, которая наступает через 7-10 суток (около 500-700 градусо-дней) при температуре инкубации через7-10 суток.
Доставленную икру после адаптации к температуре и учета загружают в аппараты Вейса (тыс. шт.) для : ряпушки, рипуса – до 900, пеляди – 800, сигов –чудского, лудоги, пыжьяна – до 300, омуля байкальского – до 300, чира, муксуна, нельмы –200.
В процессе инкубации расход воды в аппаратах регулируют. В начале инкубации (3 дня) и в конце вылупления расход составляет 0,05 л/с (3 л/мин). В период отбора уменьшают до 0,04 л/с (2,2 л/мин). Температура воды в период инкубации поддерживается 0,2-0,80С.
Первый отбор мертвой икры проводят в интервале 10-20 сут развития (обрастание 1/3 бластодермой желтка – закладка нервной борозды). Отбору подлежит поврежденная икра, неоплодотворенная и аномальная в развитии – белого цвета. Неоплодотворенная икра составляет 8-16%. Общий отход икры за период инкубации может достигать 50 %.
Затем отход икры наблюдается на стадии гаструляции и особенно на стадии замыкания бластопора. В это время не допускают перемешивания икры в аппарате. Икру из аппарата отсасывают сифоном
Большой урон инкубируемой икре наносит развитие гриба –сапролегнии, от которого необходимо своевременно освобождаться. Для дезинфекции икры в случае появления очагов сапролегнии ее промывают в контрольных аппаратах раствором малахитового зеленого 1:180000 или формалином в концентрации 1:2000.
Для инкубации икры сиговых используют чистую низко- или среднеминерализованную воду карбонатного класса без взвесей ила, песка, не загрязненную сточными водами и нефтепродуктами. В период инкубации проводят 3-4 раза полный химический анализ воды (табл. 48).
Таблица 48
Химический состав воды, необходимый в инкубационно-личиночном
сиговом цехе
| Показатели | Значение | |
| оптимальное | допустимое | |
| рН | 6,6-6,9 | 6,0-8,0 |
| СО2 , мг/л | 5-10 | 40 |
| О2, мг/л | 10-14 | 7,0-8,0 |
| Перманганатная окисляемость, мг О2/л | 4,0-10,0 | 18,0-20,0 |
| Nh5+, мг/л | 0,1-0,2 | 0,8 |
| NO2-,мг/л | 0,001 | 0,001 |
| NO3-, мг/л | 0,001 | 10,0 |
| Nh4, мг/л | 0,001 | 0,1 |
| P2O5, мг/л | 0,1-0,2 | 0,3 |
| Железо общее, мг/л | 0,001-0,01 | 0,1 |
| Са+=, мг/л | Не менее 7,0-10,0 | - |
| Na+ +K+, мг/л | Не менее 9,0-12,0 | - |
| Сульфаты, мг/л | До 0,7 | 10,0 |
| Общая жесткость, мг/л | 0,8-2,8 | 5,0 |
| Общая минерализация, мг/л | 100-250 | До 600 |
Отход икры сиговых дополнительно к количеству неоплодотворенной и погибшей при сборе и транспортировке в норме составляет: для чира - 25, озерной пеляди – 15, речной пеляди – 12 и сибирской ряпушки – 8 %.
Вылупление эмбрионов может может происходить на разных стадиях: раннее, массовое и позднее. Неблагоприятное воздействие факторов среды на последних стадиях развития может вызвать раннее вылупление. Рыбоводно-технологические нормы инкубации икры представлены в табл.49.
Таблица 49
Биотехнологические нормы инкубации икры сиговых
| Показатели | Пелядь | Чир | Муксун |
| Количество икры 1 аппарате Вейса, тыс. шт. | 600-700 | 300-500 | 350-400 |
| Температура воды в период инкубации,0С | 0,1-1,2 | 0,1-1,2 | 0,1-1,2 |
| Расход воды в аппарате Вейса, л/мин | 3-4 | 3-4 | 3-4 |
| Содержание растворенного О2, мг/л | 7-11 | 7-11 | 7-11 |
| рН | 6,5-7,5 | 6,5-7,5 | 6,5-7,5 |
| Продолжительность инкубации, сут. | 130-150 | 125-140 | 140-150 |
| Выживаемость, % | 70 | 40 | 60 |
Массовое вылупление эмбрионов чира наблюдается при весеннем повышении температуры воды до 3-40С, муксуна – до 4-6, пеляди до 6-80С. При нормальных условиях инкубации икры, полученной от производителей хорошего качества, количество дефектных эмбрионов обычно составляет 0,5-4,0 %.
studfiles.net
Особенности инкубации икры различных видов рыб. — КиберПедия
Осетровые. Снабжение инкубационных аппаратов водой с насыщением кислородом 100%, концентрацией диоксида углерода не более 10 мг/л, рН 6,5-7,5; защита от прямого солнечного света во избежание повреждения эмбрионов и появления уродов.
Для белуги весеннего хода оптимальная температура инкубации 10-15°С (инкубация при 6-8°С приводит к 100%-ной гибели, а инкубация при температуре 17-19°С сопровождается вылуплением аномальных предличинок с недоразвитым сердцем, аритмией, водянкой перикарда).
Для севрюги оптимальная температура от 14 до 25°С. При температуре 29°С наступает торможение развития эмбрионов, при 12°С – большая гибель и появляется много уродов.
Лососевидные. Оптимальный уровень кислорода при оптимальной температуре для лососевидных — 100% от насыщения, уровень диоксида углерода не более 10 мг/л (для горбуши допустимо не более 15, кеты не более 20 мг/л), рН 6,5-7,5, полное затемнение во время инкубации икры лососевых, защита от прямого солнечного света икры сиговых.
При инкубации икры лососевидных целесообразно использовать переменный температурный режим.
Для балтийского лосося, сёмги, ладожского лосося оптимальная температура 3-4°С. После вылупления оптимальная температура повышается до 5-6, а затем до 7-8°С.
Для кеты – 10°С в начале инкубации; 8,3 на этапе дробления; 7,8 в начале гаструляции; 7,1 в начале пульсации сердца; 5,3°С к вылуплению.
Для горбуши – 12-14°С в начале инкубации с понижением до 7-8 к началу пигментации глаз (8-й этап), затем до 2-3°С к моментузавершения инкубации. После вылупления предличинок (с 12-го этапа) нужно понизить температуру до 0,2-0,3°С.
Экологический диапазон эмбриогенеза сиговых находится в пределах 0,2-10°С.
Вылупление. Продолжительность периода вылупления, то есть времени в течение которого из оболочек выходят все нормальные предличинки у осетровых, например, составляет 15-28% продолжительности всего эмбрионального периода. Продолжительность вылупления — величина непостоянная и зависит не только от температуры, газообмена, других условий инкубации, но и от специфических условий (скорости течения воды в инкубационном аппарате, толчков и других), необходимых для осуществления выделения фермента вылупления и освобождения эмбрионов из оболочек. Чем хуже условия, тем дольше продолжается вылупление.
Длительность периода вылупления может служить одним из показателей состояния предличинок. Как правило, вылупление жизнеспособных предличинок из одной партии икры при нормальных экологических условиях завершается у осетровых в течение периода времени от нескольких часов до 1,5 суток, у лососевых — 3-5 суток. Сначала вылупляются единичные предличинки, затем число вылупившихся предличинок постепенно увеличивается. Момент, когда в инкубационном аппарате имеется уже несколько десятков предличинок, можно считать началом периода вылупления. Обычно после этого число предличинок быстро увеличивается и наступает массовое вылупление. Концом периода вылупления следует считать время, когда в инкубационном аппарате остаются в оболочках мёртвые и уродливые эмбрионы.
Растянутые сроки вылупления чаще всего свидетельствуют о неблагоприятных условиях среды и приводят к увеличению разнокачественности предличинок и повышению их смертности. Растянутость вылупления представляет большие неудобства для рыбоводов, поэтому важно знать, как происходит процесс освобождения предличинок из оболочек и какие условия способствуют дружному вылуплению предличинок.
Освобождение из оболочек происходит следующим образом:
• в железе вылупления, расположенной на нижней поверхности головы, образуется
особое вещество — фермент вылупления;
• оно появляется в железе после начала пульсации сердца, затем количество его
быстро возрастает вплоть до последней стадии эмбриогенеза;
• на этой стадии фермент выделяется из железы в перивителлиновую жидкость,
ферментативная активность которой резко возрастает, а активность железы снижается;
• прочность оболочек с появлением фермента в перивителлиновой жидкости быстро
падает;
• двигаясь в ослабленных оболочках, эмбрион разрывает их, выходит в воду и
становится предличинкой.
Выделение фермента вылупления и мышечная активность, имеющие первостепенное значение для освобождения из оболочек, в большой степени зависят от внешних условий. Они стимулируются улучшением условий аэрации, движением воды, толчками. Для обеспечения дружного вылупления, например осетровых, необходимы сильная проточность и энергичное перемешивание икринок в инкубационном аппарате.
Следует отметить, что аппараты Ющенко не обеспечивают достаточно дружного вылупления. В этих аппаратах оно может значительно растягиваться. Ещё менее благоприятны условия для вылупления в лоточных инкубационных аппаратах Садова и Каханской. В них оно начинается с очень большим запаздыванием — на 39-й стадии развития и затягивается до двух трёх суток. Более благоприятные условия для дружного вылупления создаются в инкубаторе «Осётр».
cyberpedia.su
Технические средства для инкубации икры (стандартная технология и холодная инкубация
Ранее при искусственном разведении взятую у рыбы и оплодотворенную икру помещали в гравий проточных водоемов.
Этот метод в более совершенной форме нередко используется и в наше время. Однако наряду с этим большое распространение получили различные инкубационные аппараты.
Аппарат Виберта. По системе Виберта пластмассовые аппараты вместимостью 0,5 л с 1 тыс. шт. икры на стадии пигментации глаз устанавливаются в гальку нерестового гнезда и предоставляются самим себе. В этих аппаратах молодь остается и после выклева и покидает свое защищенное жилище при переходе на активное плавание через предусмотренные для этого прорези. Аппарат Виберта был известен еще перед первой мировой войной.
Инкубация в аппаратах. «Полудикое» разведение форели в аппаратах Виберта не могло как метод использоваться в течение длительного времени, поскольку икринки в ящичках-лотках Виберта легко поражались грибками и погибали, а при размещении их в гальке не всегда могли быть найдены такие места, где водный поток поднимается, как на естественных нерестилищах. Поэтому вскоре перешли к инкубации икры в инкубационных цехах, чтобы можно было обеспечить тщательное наблюдение за развитием икры независимо от погодных условий. Для этих целей служит инкубатор со всевозможными вспомогательными устройствами, который стал очень важным звеном предприятия, можно сказать, его ядром. Размещать инкубатор рациональнее в отдельном помещении, хотя в небольших хозяйствах можно использовать подвальные помещения.
Для водоснабжения инкубатора, т.е. для развития икры и подращивания молоди, как правило, используется родниковая вода.
Родниковая вода с большим содержанием углекислоты непригодна. В этом случае даже интенсивная аэрация, хотя и ведет к значительному снижению содержания двуокиси углерода, не дает удовлетворительных результатов. При очень высоком содержании железа (что обычно сопутствует высокому содержанию двуокиси углерода), несмотря на коагуляцию железа на участке аэрации, расположенном между источником и инкубатором, потери икры могут быть также очень значительными. Дефицит кислорода в родниковой воде можно устранить путем использования перепада воды перед инкубатором, но при условии, что это не приведет к нежелательному изменению температуры.
Даже короткого проточного участка между истоком родника и инкубатором может быть достаточно, чтобы вода при атмосферных осадках наполнилась взвешенными мельчайшими частицами ила, что не только затрудняет инкубацию икры, но и вообще ставит под сомнение успех инкубации, так как мелкие частицы, оседающие на икринках в инкубационном лотке, могут вызвать гибель икры. Опасность заиления икры еще больше, если инкубатор снабжается лишь ручьевой водой.
Многие инкубаторы должны, таким образом, иметь фильтры, которые размещаются на внешней стенке инкубатора, что облегчает обслуживание его. Чем больше объем фильтра, тем больше его производительность и тем реже его требуется очищать. В качестве фильтрационного материала лучше всего зарекомендовал себя еловый лапник, который в течение вегетационного сезона не надо полностью обновлять, а достаточно лишь очищать при заиливании. Целесообразен двухкамерный фильтр, у которого одна камера находится в эксплуатации, а другая очищается путем удаления и промывания фильтрационного материала.
Следует ли перед фильтром добавлять еще один пруд для отстоя воды — зависит от местных условий. При большой площади водосбора, т.е. при большой удаленности источника, рекомендуется ввод дополнительного пруда для регулирования температуры. Этот пруд может служить также отстойником.
Выше рыбоводных хозяйств не допускается закладка любительских прудов.
Вода в инкубатор должна поступать самотеком, по возможности без применения каких-либо насосов. Если это невозможно, то надо установить небольшой напорный бак в инкубаторе или возле него, который должен заполняться автоматически насосом с помощью поплавкового контакта.
При достаточном уклоне вода из фильтра попадает в так называемый уровенный желоб, который проходит внутри инкубатора вдоль стены на уровне человеческого роста и снабжен многочисленными регулирующими кранами или задвижками, а снаружи имеет водослив. К этому желобу можно подключать все виды инкубационных аппаратов: лотки, шкафы, аппараты.
Инкубационные лотки. В Европе в инкубаторах применяют преимущественно продольный желоб — давно укоренившуюся форму инкубационного лотка. По условиям течения желоб имитирует маленький ручей. Если его установить на удобной высоте, то можно без труда отбирать икру.
Лотки имеют ширину от 30 до 45 см, длину несколько метров и высоту 20 - 80 см. Материалом для них могут служить дерево, бетон (для стационарных лотков), этернит, синтетическая смола, усиленная стекловолокном, или алюминий.
Калифорнийские инкубационные аппараты. Калифорнийские инкубационные аппараты в последнее время встречаются редко. Объясняется это тем, что для них требуется большой уклон, так как аппараты устанавливаются группами в лестничном порядке. В этом случае для отбора икры в верхних аппаратах необходима лесенка, а для отбора икры в нижних аппаратах приходится нагибаться. Инкубационные аппараты должны быть не очень широкими, чтобы при отборе икры не приходилось далеко тянуться.
Инкубационные рамки. Инкубируемую икру размещают в лотках на инкубационных рамках, которые находятся в подвешенном состоянии. Имеются разнообразные устройства, служащие для того, чтобы при минимальной проточности омывать заложенную на инкубацию икру максимальным количеством воды. Если лотки имеют длину не 20—30, а 80 см то в них можно подращивать молодь перешедшую на активное плавание более длительное время, чем это воз можно в плоских лотках.
Применяют также ящики с сетчатым дном, большей частью сделанные из оцинкованной листовой жести и пластика с отверстиями (ширина отверстия 1,5 - 2 мм), что гарантируй хороший водообмен.
На каждый 1 см2 можно поместить 4 икринки форели, что составит при расчете на 1 м2 40 000 шт., а при размещении в два слоя — 80 000 шт. Разумеется, что материал, на который укладывают икру, должен быть без вредным. Поэтому оцинкованную жесть покрывают инертолом. Трубы из оцинкованной жести нельзя покрасить изнутри, поэтому от них следует отказаться. Инертол служит так же для консервации материалов, предрасположенных к гниению (дерево) или для глазирования (бетон) шероховатых материалов. Для покрытия бетонных бассейнов хорошо зарекомендовала себя хлоркаучуковая краска (используемая для покрытия плавательных бассейнов).
При инкубации икры достаточен расход воды 0,5 л/с на 1 м поверхности лотка. Таким образом для инкубации миллиона икринок вначале требуется не более 6 л/с при площади лотка 12 м2.
Инкубационные шкафы. В целях уменьшения расхода воды применяются инкубационные шкафы, среди которых особое место занимает так называемый капельный инкубационный аппарат. В капельном инкубаторе икра находится не в воде, а во влажной атмосфере. Вода капает сверху, проходит через стеллаж аппаратов рамки, на которых размещена икра. Подобные устройства интересны не только с точки зрения экономии воды. В таком аппарате на одном поддоне размещается всего 100 икринок, что делает возможным проведение очень точной селекционной работы.
Еще 10 лет назад Шеперклаус описал подобный инкубационный шкаф в монастыре Мариа Лаах который является сейчас экспонатом Рейнского музея в Кобленце.
Инкубационный цех не следует делать слишком маленьким.
Инкубационные стеклянные аппараты. Несмотря на неоднократные попытки инкубация в стеклянных сосудах ограничивается лишь теми видами рыб, у которых мелкая или клейкая икра. Такие цилиндры, представляющие собой перевернутые вниз горлом бутыли объемом 5 - 8 л без дна, в которые вода поступает снизу, называют аппаратами Вейса. С помощью поступающего снизу точно дозированного потока воды икра находится в постоянном движении, и поэтому икринки не склеиваются друг с другом. Мертвая икра из-за ее малого удельного веса смывается через край, т.е. отбирается автоматически.
Расход воды на один аппарат Вейса составляет 0,1 л/с.
Входное отверстие должно иметь диаметр свыше 18 мм для более равномерного перемешивания всей массы икры.
Аппараты Макдональда. В Америке в настоящее время для инкубации икры используют стеклянные цилиндры, закрытые снизу. Приток воды в них осуществляется через вертикально опущенную трубку. При инкубации икры сигов выклюнувшихся личинок выпускают в водоем или при необходимости переносят в установки для подращивания, а при инкубации икры щуки незадолго до выклева молодь переносят в особые, слабопроточные лотки с площадью основания около 0,5 м2 каждый, в которых личинки выклевываются, и потом прикрепляются к решеткам и стенкам. Когда личинки израсходуют запасы пищи в желточном мешке, они переходят к активному образу жизни, становятся головой против течения и начинают активно питаться. На этой стадии их пересаживают в естественные водоемы.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
megalektsii.ru
Способ и устройство для инкубации икры рыб
Устройство представляет собой прозрачный сосуд для инкубации икры цилиндрической формы, суживающийся книзу, заканчивающийся горловиной и имеющий верхнее и нижнее отверстия. К нижнему отверстию присоединяется водоподающая система, включающая трубу, внутренний диаметр отверстия которой совпадает с внутренним диаметром горловины сосуда. Горловина и труба соединены встык, при этом в горловине предусмотрен обратный клапан для исключения попадания икры в водоподающую систему. Устройством реализуется способ, согласно которому предусматривают закладку оплодотворенной икры в инкубационный аппарат, регулируемую подачу воды через нижнее отверстие, создающую восходящий поток воды, поддерживающий икру во взвешенном состоянии до конца инкубации. Подачу воды в период развития икры от начала эмбриогенеза до стадии пигментации глаз производят с расходом, обеспечивающим подъем икры в инкубационном сосуде, несопровождаемый ее последующим движением. Изобретение обеспечивает минимальное механическое воздействие на икру при инкубации и увеличение фактического выхода личинок от инкубируемой икры. 2 з. и 1 з.п. ф-лы, 1 ил.
Изобретение относится к искусственному воспроизводству рыбных запасов, а именно к инкубации икры с повышенной чувствительностью к механическим воздействиям.
В зависимости от видоспецифической устойчивости зародышей рыб к механическим воздействиям икру на рыбоводных заводах инкубируют в подвижном или неподвижном состоянии.
Известно, что икру рыб, отличающуюся особой чувствительностью к механическим воздействиям, инкубируют в неподвижном состоянии, например, в аппаратах лоткового типа. Икру раскладывают на сетку, которая покрывает дно инкубационного ящика, в 1-1,5 слоя. Создают поток воды в ящике, при этом вода омывает икру, не перемещая ее в пространстве, погибшую икру отбирают вручную (Справочник рыбовода, под ред. Н.И. Кожина, «Пищевая промышленность», М. 1971 г., с.37).
Недостатком такого способа является низкая производительность. На одну инкубационную рамку раскладывается 2,5-8 тыс. икринок в зависимости от вида рыб. Способ не обеспечивает «самоотборку» мертвой икры, а мертвая икра отбирается поштучно пипеткой или пинцетом. Трудоемкость этого процесса делает его непригодным, например, для сиговодства, где производственная мощность инкубационного цеха измеряется десятками или сотнями миллионов икринок.
Наиболее близким по технической сущности и достигаемому результату является способ инкубации икры сиговых рыб в циркулирующем потоке воды.
Оплодотворенную икру закладывают в инкубационные аппараты. Вода из напорной емкости стойки поступает через шланг в нижнюю часть сосуда и поднимает икру в центральной части сосуда вертикально вверх. В верхней части сосуда напор воды ослабевает, икринки вытесняются восходящим потоком от центра на периферию и затем начинают опускаться вниз вдоль стенок сосуда к водоподающему штуцеру, где они вновь увлекаются вверх потоком поступающей воды. Таким образом, икра в течение всего периода инкубации циркулирует в аппарате, находясь во взвешенном состоянии в толще воды. Интенсивность циркуляции икры в аппарате регулируется расходом воды с целью обеспечения «самоотборки» мертвой икры. Удельный вес погибшей икры несколько меньше, чем живой. Рыбоводом настраивается расход воды таким образом, чтобы мертвая икра не вовлекалась в общую циркуляцию икры и концентрировалась в верхней части аппарата, откуда она периодически удаляется при помощи сифона (Б.И. Черфас Рыбоводство в естественных водоемах. М., «Пищевая промышленность», 1956, с.131, 139).
Такой способ инкубации допускает относительно высокую плотность загрузки икрой инкубационного сосуда (например, сиговых до 500 тыс.икринок), а простота отбора мертвой икры обеспечивает высокую производительность процесса. Но такая биотехника инкубации не пригодна для рыб, икра которых чувствительна к механическим воздействиям на ранних сроках развития.
Известно устройство для инкубации икры сиговых рыб, представляющее собой прозрачный цилиндрический сосуд, суживающийся книзу, имеющий нижнее и верхнее отверстия для подачи и слива воды. Нижнее отверстие закрыто штуцером-воронкой. На штуцер надет водоподающий шланг, по которому подается вода из напорной емкости. (Методические указания по сбору и хранению икры сиговых рыб на временных рыбоводных пунктах, ее транспортировке и инкубации. М.: Минрыбхоз СССР, Главрыбвод, 1987, с.40-41, 49).
При таком подключении к водоподающему шлангу икра, попадая в струю воды, бьющую из узкого канала штуцера, испытывает максимальные механические нагрузки в нижней части сосуда, что может приводить к повреждению развивающихся зародышей.
Технический результат от использования предлагаемых технических решений заключается в создании эффективного способа и устройства инкубации икры рыб, обеспечивающих минимальное механическое воздействие на икру при инкубации, и увеличение фактического выхода личинок от инкубируемой икры.
Технический результат достигается тем, что в способе инкубации икры рыб, включающему закладку оплодотворенной икры в инкубационный аппарат, регулируемую подачу воды через нижнее отверстие, создающую восходящий поток воды, поддерживающий икру во взвешенном состоянии до конца инкубации, при этом подачу воды в период развития икры от начала эмбриогенеза до стадии пигментации глаз производят с расходом, обеспечивающим подъем икры в инкубационном аппарате, несопровождаемый ее последующим движением.
Для осуществления способа предлагается устройство, представляющее собой прозрачный сосуд для инкубации икры цилиндрической формы, суживающийся книзу, заканчивающийся горловиной и имеющий верхнее и нижнее отверстия, к последнему присоединяется водоподающая система, которая включает трубу, внутренний диаметр отверстия которой совпадает с внутренним диаметром горловины сосуда, для обеспечения максимального сечения потока в устьевой зоне инкубационного сосуда и вертикальной направленности потока в центральной части, горловина и труба соединены встык, например, эластичным шлангом, при этом в горловине предусмотрен обратный клапан для исключения попадания икры в водоподающую систему.
Кроме того, нижний конец водоподающей трубы подсоединен к шлангу подачи воды от водонапорной емкости через угольник, предотвращающий излом шланга при его минимальной длине.
Такое заявляемое конструктивное решение устройства для инкубации икры учитывает, что при одинаковом расходе воды, скорость потока у горловины в нижней устьевой части сосуда обратно пропорциональна размеру внутреннего диаметра нижнего отверстия. В связи с этим ускорение, которое будет испытывать икра, попадающая в поток в устьевой части инкубационного сосуда и, соответственно, действующая на нее сила, будут пропорционально уменьшаться с увеличением диаметра входного отверстия, что и обеспечивает в предлагаемом способе минимальное механическое воздействие на икру при инкубации в первый период развития, снижая риск повреждения развивающихся зародышей, и, тем самым, увеличивая фактический выход личинок от инкубируемой икры.
Это позволяет сделать вывод о том, что заявляемые объекты связаны единым изобретательским замыслом.
На чертеже схематично изображено устройство для инкубации икры рыб, представляющее цилиндр (I) с верхним отверстием (3) и суживающийся книзу (устьевая часть) (2), максимальное сечение потока в устьевой зоне сосуда обеспечивается за счет соединения встык нижнего отверстия горловины (4) с отрезком трубы (5), внутренние диаметры трубы и горловины совпадают. Соединение обеспечивается отрезком шланга (6) необходимого диаметра, верхний конец которого надевается на цилиндрическую горловину сосуда, а нижний - на трубу. Такое подключение обеспечивает вертикальную направленность потока в центральной части сосуда, что важно при работе аппарата в режиме «самоотборки» мертвой икры. Для исключения попадания икры в трубу, в случае отключения водоподачи, предусмотрен обратный клапан (7). Нижний конец трубы через угольник (90°) (8) соединяется с переходником (9), позволяющим подключить резиновый шланг (10) к крану (II) и напорной емкости (12). Использование угольника предотвращает излом водоподающего шланга при его минимальной длине.
Способ инкубации икры осуществляют следующим образом.
В инкубационный аппарат через верхнее отверстие загружают оплодотворенную икру чувствительную к внешним воздействиям на ранних этапах развития, например, чира. Подключают систему водоподачи. Настраивают расход воды 1,9-2,0 л/мин., который обеспечивает подъем икры в сосуде, несопровождаемый ее последующим движением. Такой расход воды поддерживают при инкубации в течение первых 40-50 суток эмбриогенеза. Обездвиженная икра не испытывает существенных механических нагрузок и воздействие этого негативного фактора на начальных этапах развития нейтрализуется. Устойчивость к механическим повреждениям повышается со стадии пигментации глаз, что соответствует 40-50 суткам развития икры при температурной технологической норме. Сначала пигментации глаз зародыша расход воды увеличивается до 2,2-2,4 л/мин., икра переходит в подвижное циркулирующее состояние, инкубационный аппарат настраивают на отборку мертвой икры. Такой обычный способ инкубации сохраняют до выклева предличинок.
Таким образом, положительный эффект от изменений в технологии достигается за счет инкубации икры, например, сиговых, в двух последовательных режимах:
- инкубация в состоянии покоя (без движения в сосуде) в период повышенной чувствительности зародышей к механическим воздействиям;
- инкубация при расходе воды, обеспечивающем циркуляцию икры в аппарате, до конца эмбриогенеза.
Последовательное использование двух режимов расхода воды позволяют сочетать положительные качества двух способов инкубации икры в одном устройстве.
Описанные способ инкубации икры сиговых (чира) и устройство были испытаны в условиях Сузгунского инкубационного цеха Абалакского экспериментального рыбоводного завода (АЭРЗ). Отход от живой икры в двух экспериментальных модернизированных аппаратах составил 6 и 11%, тогда как в обычных аппаратах его величина достигла 46%. Предлагаемые способ и устройство инкубации икры успешно используются на этом предприятии в течение 7 лет, что позволило получить около 50 млн личинок чира.
В 2011 году в этом инкубационном цехе предложенные технические решения были успешно апробированы на икре муксуна.
1. Способ инкубации икры рыб, включающий закладку оплодотворенной икры в инкубационный аппарат, регулируемую подачу воды через нижнее отверстие, создающую восходящий поток воды, поддерживающий икру во взвешенном состоянии до конца инкубации, отличающийся тем, что подачу воды в период развития икры от начала эмбриогенеза до стадии пигментации глаз производят с расходом, обеспечивающим подъем икры в инкубационном сосуде, не сопровождаемый ее последующим движением.
2. Устройство для инкубации икры рыб, представляющее собой прозрачный сосуд для инкубации икры цилиндрической формы, суживающийся книзу, заканчивающийся горловиной и имеющий верхнее и нижнее отверстия, к последнему присоединяется водоподающая система, отличающееся тем, что система водоподачи включает трубу, внутренний диаметр отверстия которой совпадает с внутренним диаметром горловины сосуда, для обеспечения максимального сечения потока в устьевой зоне инкубационного сосуда и вертикальной направленности потока в центральной части, горловина и труба соединены встык, например, эластичным шлангом, при этом в горловине предусмотрен обратный клапан для исключения попадания икры в водоподающую систему.
3. Устройство по п.2, отличающееся тем, что нижний конец водоподающей трубы подсоединен к шлангу подачи воды от водонапорной емкости через угольник, предотвращающий его излом при его минимальной длине.
www.findpatent.ru