Рекомендации по индустриальному выращиванию сиговых рыб. Инкубация икры
Инкубация икры
ПодробностиПросмотров: 1083
Инкубация икры проводится в закрытых помещениях. Икразакладывается в стандартные аппараты Вейса объемом 8 л притемпературе воды от 2,7 до 8,5 С. Насыщение воды кислородомв период инкубации должно составлять 7–11 мг/л – не ниже 60%насыщения, активная реакция воды, благоприятная для инкубацииикры, – 6,5–7,5 ед. рН.В период инкубации необходимо соблюдать разработанныеранее рекомендации (Головков, Кузьмин, 1963; Понеделко, Крупкин,1975; Головков и др., 1978; Слуцкий, Ефанов, 1980).Расход воды на один аппарат Вейса устанавливаютв зависимости от количества и стадии развития икры и содержаниякислорода в воде. На чувствительных стадиях развития и в период«самоотбора» расход воды в аппаратах не должен превышать2,2–2,4 л/мин., чтобы не подвергать икру значительным механическимвоздействиям. На стадии развития подвижного эмбриона расход водыможет быть увеличен до 2,6–2,8 л/мин. Максимально допустимыйрасход воды в аппаратах Вейса при инкубации (3–3,5 л/мин.) обычноприменяется только на поздних стадиях развития икры.Икра закладывается в аппараты Вейса по 5 л, то есть около300 тыс. икринок. Продолжительность инкубации составляет 160–180 сут. Выход свободных эмбрионов от заложенной на инкубациюикры – 60–70%. Нормы загрузки и основные биотехнологическиенормативы инкубации икры сига приведены в табл. 5.237Таблица 5. Биотехнические нормы инкубации икрыволховского сигаПоказатели ЗначенияКоличество икринок в одном аппарате, тыс. шт. 300Температура воды в период инкубации*, С 0,2 – 0,5Расход воды в аппарате, л/мин. 2 – 3,5Содержание растворенного в воде кислорода, мг/л не менее 7Водородный показатель, ед. рН 6,5 – 7,5Продолжительность инкубации, сут. 165 – 180Выживаемость за инкубацию, % 60 – 70* Температура воды в зимние месяцыМассовое вылупление эмбрионов волховского сигапроисходит при весеннем повышении температуры воды до 3–4,5 С.Сроки определяются погодными условиями, варьируя с 10 – 25 апрелядо 3 – 5 мая. Масса личинок – 6–8 мг.Температурный режим. Соблюдение оптимальноготемпературного режима в период инкубации является основнымтребованием, обуславливающим нормальное развитие эмбрионов(табл. 6). Его нарушение сопровождается не только повышеннымиотходами икры на разных этапах эмбриогенеза и преждевременнымабортивным вылуплением нежизнеспособных эмбрионов, но иотклонениями в развитии эмбрионов, которые проявляются в видеразличных уродств при выдерживании и подращивании личинок.Таблица 6 . Температурные показатели развития икры сига (С)
Контроль и отбор погибшей икры. В течение всего периодаинкубации проводятся отбор и учет мертвой икры, корректировкаобмена воды в аппаратах, ежедневное измерение температуры воды исодержания кислорода, наблюдения за развитием икры.Основные технологические работы по уходу за развивающейсяикрой проводят в периоды пониженной чувствительности. В началеразвития икра сиговых рыб характеризуется слабой дыхательнойактивностью и может переносить довольно низкое содержаниекислорода в воде. После образования эмбриональной системыкровообращения и далее вплоть до вылупления дыхательнаяактивность эмбрионов значительно возрастает, что даже прикратковременном нарушении проточности может привести к гибелиикры в аппарате. В этот период наблюдается повышенная гибельэмбрионов на стадии закладки осевых органов: постепенно белея, ониконцентрируются в верхней части аппаратов, откуда их удаляютсифонами.При небольших объемах производства отбор погибшей икрыосуществляется вручную посредством сифона в период самоотбора,основанном на разностях относительных плотностей живой и мертвойикры. Процесс самоотбора икры длится примерно 90 суток, егоинтенсивность одинакова как в начале инкубации на этапе дробления,так и на этапе формирования жаберно-челюстного аппарата.Профилактические мероприятия. При появлении ваппаратах сапролегнии необходимо обработать икру одним изкрасителей:– малахитовый зеленый со степенью разведения 1/200000,длительность обработки 50 мин;– фиолетовый с концентрацией 5мг/л, длительность обработки25 мин.В случае появления комков из пораженной сапролегнией икрыможно освободить икринки от гифов гриба механическим способомначиная с этапа окончания гаструляции, т.е. когда икринки становятсяупругими, относительно прочными и мало восприимчивыми кмеханическому воздействию и давлению.Вылупление свободных эмбрионов и выдерживание личинок.Массовое вылупление эмбрионов сига наблюдается в конце апреля –начале мая при повышении температуры воды до 3–4,5 С. Приоптимальной температуре период вылупления эмбрионов длится от4–5 до 15 суток.После вылупления эмбрионы выносятся током воды изаппаратов в уловители – глубокие проточные бассейны. Изуловителей их переносят в тазы, в которых оболочки эмбрионовоседают. Освобожденных от оболочек личинок помещают в бассейныцеха выращивания молоди, где проводится их подращивание.Нормально развитые эмбрионы сига имеют длину 11–14 мм,массу – 5,0–7,5 мг (табл. 7). Жировая капля занимает третью частьжелтка, тело слабо пигментировано.Таблица 7. Морфометрические показатели свободных эмбрионовволховского сига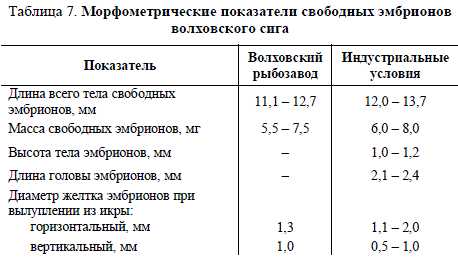
Главная – Сибирская рыба
Аквакультура в Сибири
Рекомендации по индустриальному выращиванию сиговых рыб
Муксун
Омуль
Пелядь
sibir.arktikfish.com
Инкубация икры
ПодробностиПросмотров: 559
Исследование абиотических условий эмбрионально-личиночного развития лососей в естественных нерестовых буграх и на рыбоводных предприятиях по-зволяет оценить эффективность инкубации икры в зависимости от основных фак-торов среды и определить оптимальный режим инкубации. Кроме того, структура нерестовых бугров, характер расположения икры, особенности водообмена в нерестовых гнездах представляют собой основу для совершенствования инку-бационных аппаратов и повышения эффективности использования их на рыбо-водных предприятиях [68].При инкубации икры, прежде всего, следует создать благоприятные усло-вия для нормального развития зародышей. Для этого необходимо регулярно уда-лять конечные продукты обмена, выделяемые зародышами, обеспечивать разви-вающихся зародышей необходимым количеством кислорода, требуемой темпера-турой и определенным гидрохимическим режимом [54; 124]. Во время инкубации икры необходимо бесперебойно снабжать доброкачественной чистой водой все инкубационные аппараты, лотки, секции питомника, обеспечивать необходимую проточность в аппаратах, поддерживать благоприятный температурный, кисло-родный и световой режимы, бороться с заболеваниями икры. Для этого икру сле-дует систематически просматривать икру и осуществлять измерения по основным гидрохимическим показателям, таким как содержание кислорода, рН, содержание железа, а также температура воды и содержание взвешенных веществ. Из опыта работы сахалинских заводов, обобщенного нами, следует, что наилучшие результаты показаны при инкубации икры лососевых в аппаратах ящичного типа двух видов: аппараты типа «бокс» вместимостью 500 тыс. икры кеты и 600 тыс. икры горбуши и аппараты типа Аткинса, вместимостью одного отсека 100 тыс. икры кеты и 120 тыс. икры горбуши (Рисунок 21 Приложения Б).Размер аппарата Аткинса 3500×350×300 мм, причем лотки разделены на 4 отсека. Икра помещают в аппараты на сетчатые поддоны в «навал». Вода цирку-лирует снизу вверх, проходит через донную сетку омывает икру и выходит в при-емную камеру следующего отсека. Приемная камера каждого из отсеков имеет донное щелевидное отверстие, через которое вода направляется в следующий от-сек и снова проходит снизу вверх сквозь икру. Каскадный уровень вод в аппара-тах Аткинса создается наборными шандорными пластинами, количество которых уменьшается от верхнего к нижнему отсеку. Расход воды на один инкубационный аппарат Аткинса в зависимости от стадии развития икры варьирует от 20 до 30 л/мин, причем от начала к концу инкубации потребность эмбрионов в кислороде, как и количество выделяемых метаболитов возрастают. Эти аппараты удобны при закладке икры на инкубацию небольшими партиями, например, в начале и конце периода сбора икры, или на предприятиях с малой мощностью.Каскадный уровень вод в аппаратах «бокс» создается путем их ступенчатой установки на специальной платформе секциями по шесть боксов, расположенных попарно ступеньками один над другим (Рисунок 22 Приложения Б). Вода также как в аппаратах типа «Аткинса» циркулирует снизу вверх, омывает икру и пере-текает из впереди стоящего бокса в последующий (Рисунок 7). В боксах нет съем-ных шандор, они оборудованы сливным отверстием с пробкой, которое позволяет осушать инкубационный аппарат после завершения процесса инкубации икры или во время проведения «сухого» маркирования, а также промывания икры от заиле-ния в процессе инкубации. На вытоке из каждого бокса закрепляют защитную сетку, предотвращающую утечку икры во время инкубации. Конструкция аппара-тов и схема их установки (каскадом) обеспечивают, при правильном уходе за ик-рой, 100 %-ную ее омываемость. Размеры боксов 900х640х550 мм. Расход воды на один ряд боксов (3 шт.) в начале инкубации следует устанавливать в пределах 50–60 л/мин [75; 76]. Водоподача на каждый ряд аппаратов осуществляется шаровы-ми кранами, с помощью которых можно регулировать расход. 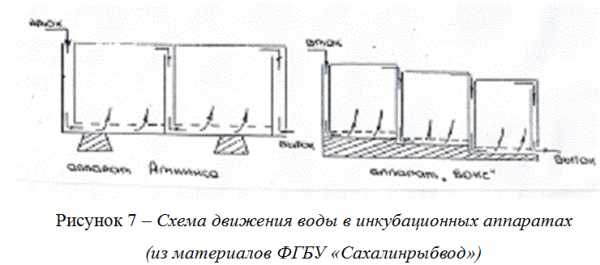 Рисунок 7 – Схема движения воды в инкубационных аппаратах(из материалов ФГБУ «Сахалинрыбвод»)
Рисунок 7 – Схема движения воды в инкубационных аппаратах(из материалов ФГБУ «Сахалинрыбвод»)
В отличие от аппаратов дальневосточного типа, которые широко использо-вали на сахалинских ЛРЗ до реконструкции, водоснабжение инкубационных ап-паратов типа бокс и Аткинса выгодно отличается: на каждый каскад из «Боксов» вода подается независимо из водоподающего лотка, а водоснабжение аппаратов дальневосточного типа было зависимого типа, то есть, стопки с икрой расставля-ли от первых партий сбора снизу вверх по течению, вследствие чего икра, нахо-дящаяся в «нижних» аппаратах, омывалась водой с меньшим количеством кисло-рода, по сравнению с «верхними» аппаратами. Кроме того, специальные транспортировочные ящики вместимостью 25 кг и большой объем «боксов» позволяют икру на инкубацию помещать непосредст-венно «переливанием» из транспортировочного ящика в инкубационный аппарат, т.е., минуя раскладку икры на рыбоводные рамки (Рисунок 23 Приложения Б). В случае перевозки икры в транспортировочных ящиках вместимостью 50 кг икру после выравнивания температуры воды следует помещать в инкубационные аппа-раты при помощи кружки с сетчатым дном, при этом кружки необходимо просчи-тывать (Рисунок 24 Приложения Б).До введения в эксплуатацию нового оборудования раскладку икры на рыбо-водные рамки производили следующим образом: пустые рамки ставили в «рас-кладочный» специальный желоб, наполненный водой. Желоб во время раскладки икры на рамки находился в рабочей комнате цеха, при комнатной температуре воздуха, комфортной для рабочих-рыбоводов. Икру из транспортировочного ящика набирали в кружку с сетчатым дном или в тюлевый сачок и в воде раскла-дывали на рамки. На одну рамку помещали 2500 икринок кеты и 3000 икринок горбуши. После того, как икра была разложена на 10 рамок, их ставили одна на другую и вкладывали в так называемые стойки. Сверху для утяжеления рамки с икрой накрывали дополнительной рамкой с металлической сеткой или помеща-ли на верхнюю рамку груз во избежание всплывания рамок с икрой. После напол-нения двух стопок рабочий при помощи специальных крючков относил их в ин-кубатор и помещал в аппараты. Длительность процесса раскладки икры на рамки зависела от квалификации и опыта рабочих, но, как правило, составляла от 2–3 до 10 минут. Все это время икра испытывала температурный шок. В целом, инку-бационный отход во многом зависел также от скорости раскладки икры и опыта рабочих – рыбоводов. Омываемость икры в инкубационных аппаратах дальнево-сточного типа при указанной плотности икры на рамках была неудовлетворитель-ной и не благоприятствовала как поступлению кислорода, так и выносу продуктов метаболизма. Отход икры, инкубируемой на рамках, достигал 50–80 % за период инкубации из-за высокой плотности размещения и плохой омываемости икры во-дой, и, как следствие, вторичного поражения сапролегниозом.
Смотрите также
Лососи в аквакультуре
Бассейновый метод выращивания лососевых рыб
Лососи - Главная
Особенности исскуственного воспроизводства тихоокеанских лососей
Тихоокеанские лососи
Атлантический лосось на севере России
losos.arktikfish.com
Инкубация икры при выращивании лососевых
Строение икры. Икра имеет почти шаровидную форму, только перед выклевом происходит ее деформация.
Внутри икринок имеется желток, пропитанный жировыми каплями, за счет которого эмбрион в икринке растет и часть которого после выклева он уносит с собой в желточном мешке и питается его содержимым, прежде чем сможет активно брать пищу из окружающей среды.
На желтке размещается зародышевый диск, с которого начинается развитие зародыша. Желток окружен тонкой оболочкой — желточной мембраной, которая отделяет его от «буферной зоны» — перивителлинового пространства. Перивителлиновое пространство окружено пористой внешней оболочкой. Через самую крупную пору — микропиле могут проникнуть несколько сперматозоидов, но лишь один попадает в область зародышевого диска, и с этого момента начинается развитие эмбриона.
Поскольку икра находится в воде, то перивителлиновое пространство через поры в оболочке впитывает воду и начинает набухать. При этом через несколько минут микропиле закрывается, и неоплодотворенная икра теряет способность к оплодотворению. Процесс набухания продолжается затем еще несколько часов, икринка увеличивается в объеме, оболочка натягивается, набухшая икра становится более прочной, и ранее легко ранимая желточная мембрана теперь становится более защищенной. Увеличение объема икринки составляет всего 20%.
Сухой способ оплодотворения. При влажном способе оплодотворения в наполненной водой миске смешивают икру и молоки. Если они не очень хорошо и быстро перемешиваются, то в результате не каждая икринка соприкасается со сперматозоидами. Последние, хотя и очень подвижны, но в воде сохраняют способность к оплодотворению в течение всего одной минуты.
При сухом способе оплодотворения сначала отцеживают икру от нескольких самок в миску без воды и потом, в зависимости от количества икры, отцеживают сперму от двух или трех самцов. В этом случае икра набухает не сразу и сперматозоиды еще не приобретают полной подвижности. Икру и молоки осторожно и тщательно перемешивают, затем добавляют воду и оставляют на несколько минут. Затем икру промывают и помещают (иногда с помощью ковшика) в инкубационный лоток. При использовании ковшика определенного объема можно одновременно приблизительно определить количество икры. На рамках икру необходимо равномерно распределить с помощью перышка.
С этого момента один химический и два физических фактора окружающей среды — содержание кислорода, свет и температура воды — определяют дальнейшее развитие икры.
Потребление кислорода. В процессе эмбрионального развития потребление кислорода повышается почти в 20 раз. С момента оплодотворения до выклева личинки одна икринка форели расходует 3 мг кислорода (икринка сига, меньшая по размерам, потребляет 0,5 мг).
Потребление кислорода выклюнувшимися личинками в 10 раз больше, чем икрой, поэтому вода в инкубационных аппаратах должна быть хорошо насыщена кислородом. Дефицит кислорода ведет к отмиранию икры или отрицательно влияет на развитие эмбриона и позднее приводит к появлению уродливых рыб. В то же время незначительное потребление кислорода в начальный период эмбрионального развития делает икру более пригодной для перевозки.
Интенсивность дыхания рыб зависит от температуры воды: при повышенной температуре рыбы дышат интенсивнее, и икра потребляет больше кислорода. Так, одна икринка форели при температуре воды 10° С требует кислорода в 30 раз больше, чем при 0°С.
Расход кислорода зависит от величины поверхности дыхания. Например, икра сига потребляет почти удвоенное количество кислорода по сравнению с икрой форели, так как 1 л икры сига имеет большую поверхность дыхания, чем 1 л икры форели.
Влияние освещенности. Известно, что в лотках икра должна быть закрыта крышкой, так как она очень чувствительна к свету, под влиянием которого повышаются отходы, особенно если падающий свет содержит ультрафиолетовые лучи. Это связано с тем, что развитие эмбриона ускоряется при освещении, и если икра находилась на свету, то личинки, выклюнувшиеся из нее, растут сначала быстро, а потом отстают в росте, и их плавательная способность снижается.
При длительном облучении уже перед стадией глазка отходы могут составлять 100%.
Икра рыб, которую инкубируют обычно в аппаратах Вейса, где невозможно создать затемнение, менее чувствительна к свету. В этом заключается различие между искусственными и естественными условиями развития икры.
Зависимость от температуры. Среди вышеназванных факторов температура играет важнейшую роль. Нерест проходит в декабре при температуре 20° С. В природе в первые недели инкубации температура воды близка к 0°С.
Для щуки, которая иногда уже в феврале начинает нереститься при температуре воды приблизительно 0°С, оптимальная температура инкубации выше — 4—11° С. Но ее икра может переносить температуру и до 22° С.
Чем теплее вода в интервале между критической точкой холода и точкой тепла, тем быстрее развивается икра.
Если речь идет не о родниковой воде с приблизительно постоянной температурой, то температура в течение периода инкубации, который начинается (у ручьевой форели) уже в ноябре и может закончиться (у радужной форели) в конце апреля, должна сначала немного снижаться, а затем повышаться почти до 12° С, кроме того, в течение суток температура должна снижаться утром и повышаться вечером. Поэтому очень трудно математически точно определить зависимость между температурой и продолжительностью инкубации.
Периоды чувствительности. В первые 36 ч после оплодотворения икра еще довольно крепкая и ее можно упаковать и перевезти. Самыми критическими являются 14 дней после оплодотворения (от 90 до 150 градусо-дней). К этому времени многоклеточный, выпяченный в форме полого шара зародышевый диск закрывается. Затем наступает стадия глазка, характеризующаяся повышенной устойчивостью. На этой стадии через оболочку (капсулу) икры можно различить образовавшиеся глаза эмбриона. Эта стадия развития икры означает, что с момента оплодотворения икра миновала период повышенной чувствительности. Этот момент чаще всего используют для перевозки икры. Затем устойчивость постепенно снижается и достигает минимума перед выклевом. Тогда наблюдаются наибольшая чувствительность и максимальные отходы икры.
Круглая икринка перед выклевом деформируется, и эмбрион начинает производить судорожные движения. В паузах он остается неподвижным. Прочность икринки в это время снижается из-за распада оболочки под действием ферментов. Из лопнувшей оболочки эмбрион часто выходит с трудом хвостом вперед путем убыстряющихся движений и затем остается лежать на сетчатой решетке инкубационного аппарата. Эмбрион перешел в личиночную стадию (молодь с желточным мешком). Личинки, хотя они и не могут плавать, «встают» головой против течения. В результате колебательных движений, частота которых напоминает вибрацию, они уже могут менять положение.
Стадии развития икры. Определить приблизительный срок выклева личинок можно с помощью градусо-дней. Например, икра, которую выдерживали при постоянной температуре воды 10° С в течение 10 дней, пребывала в ней 10X10=100 градусо-дней. В развитии от только что оплодотворенной икры до стадии, когда молодь начинает активно двигаться и питаться, можно выделить три этапа: от оплодотворения до стадии пигментации глаз; от стадии глазка до выклева; от выклева до активного питания и движения.
Обработка малахитовым зеленым. Эмбрион в своей капсуле защищен от проникновения микроорганизмов и инфекции, но внешние паразиты (грибок) опасны для него, поэтому икру обрабатывают с помощью медикаментов. В качестве универсального средства в настоящее время используют малахитовый зеленый — сильно окрашивающее органическое соединение, которое при неосторожном обращении может вызывать у человека кожные заболевания. Периодичность применения препарата зависит от состояния икры.
Во время применения препарата воду из лотка с икрой наполовину приспускают, прекращают ток воды и добавляют 0,1%-ный раствор малахитового зеленого (1 г на 1 л), оставляют на 1 мин для воздействия препарата и снова дают приток воды. При концентрации малахитового зеленого 0,1 г на 100 л воды такую ванну можно проводить в течение 1 ч.
Американцы в лотке, подводящем воду к инкубационным аппаратам, монтируют сразу же и установку с малахитовым зеленым.
Подсчет икры. Подсчет икры осуществляют для продажи или для контроля плодовитости производителей, а также для определения исходных данных для последующего подсчета процента потерь.
Подсчет икры проводят в период пониженной чувствительности икры, т. е. в стадии глазка. При подсчете достаточно знать число икринок, которое можно довольно точно определить при загрузке икры в инкубационные аппараты с помощью мерного ковшика или просто по площади закладки.
Для более точного подсчета используют счетные пластинки — небольшие алюминиевые или пластмассовые доски с определенным количеством круглых углублений, в которые попадает икра. Этот метод, хотя и требующий много времени, является самым точным.
Если икринки однородны по своим размерам или икринки разных размеров равномерно распределены по всей массе икры, можно подсчитать один раз то количество икры, которое занимает определенный объем ее (около 50 мл), и затем проводить подсчет, исходя из этой меры объема.
Количество икры можно определить также с помощью мерного цилиндра. В этом случае вытесненный 1000 икринок объем воды из цилиндра измеряют с помощью сообщающегося сосуда. Подсчет икры для продажи также осуществляют объемным способом.
Наконец, используется весовой метод подсчета икры, для чего сначала взвешивают 1000 икринок, затем всю массу икры и путем пересчета определяют общее количество икринок. Имеются также фотоэлектрические счетчики и отборщики, которые подсчитывают свыше 30 икринок в 1 с. Однако подобные методы подсчета целесообразно применять лишь в больших селекционных хозяйствах и на предприятиях по производству икры, а не в хозяйствах, занимающихся выращиванием товарной рыбы.
Перевозка икры. При перевозке икры рыбоводные хозяйства используют обычный городской транспорт или транспорт экспедиционных организаций, поскольку сами они перевозкой не занимаются. Небольшие партии часто увозят сами покупатели. Но бывает, что икру перевозят на сотни или (если речь идет о перевозке с помощью авиации с континента на континент) на тысячи километров. В таком случае икру перевозят только на стадии глазка, но ни в коем случае не перед выклевом.
Рамки для перевозки икры. Для перевозки икру следует тщательно упаковать. Прежде для икры форелей и лосося использовали деревянные рамки, обтянутые марлей, которые устанавливали друг над другом, и икру располагали на них в один слой. В настоящее время используют поддоны из пластмассы.
Если рамки и поддоны по высоте чуть больше диаметра икры, то верхняя не заполненная икрой рамка несколько выше. Ее заполняют льдом, который при перевозке медленно тает, талая вода стекает на рамки с икрой, поддерживая ее во влажном состоянии, т. е. применяют тот же способ сохранения икры, что и в капельных инкубационных аппаратах.
Просачивающаяся через стопку рамок вода собирается в поддоне, образующем квадратную основу штабеля. Его заполняют мхом или пористым материалом, чтобы вода не проникала за пределы поддона и не увлажняла картонные коробки, в которые вставляют стопку рамок. Вокруг нее закладывают изоляционный слон из газет, стекловаты, древесной стружки или минеральной ваты, который защищает содержимое штабеля от ударов. Еще лучше в качестве изоляционного материала использовать стиропоровые полоски.
Перевозка в бидонах. Небольшие количества икры на небольшие расстояния можно перевозить в каннах для рыбы или пластмассовых мешках. В них можно перевозить также икру щуки, сиговых и других видов рыб. Поскольку перевозку осуществляют в период пониженной чувствительности, то вначале из общей массы икры следует удалить неоплодотворенную икру путем ее погружения в раствор поваренной соли в соотношении 1:9. Однако концентрация солевого раствора настолько высока, что не исключена гибель из-за осмотического давления. Поэтому лучше предварительно определить процент мертвой икры с помощью раствора Хофера.
Маркировка бидонов. Транспортные канны или коробки должны иметь маркировку. На наклейках следует указать не только «верх» груза, но и его содержимое («живой груз»), чувствительность к ударам и перепадам температуры.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Инкубация икры сиговых рыб
Для инкубации икры сигов следует использовать экономичные и простые по конструкции аппараты Вейса с восходящим током воды, в которых возможно создать наиболее благоприятные условия для развития эмбрионов сиговых.
Аппарат Вейса представляет собой стеклянный или суживающийся книзу пластиковый цилиндр с пробкой на узком конце. Его форма напоминает перевернутую бутылку с отрезанным дном. В пробку вставляется синтетическая или металлическая трубка диаметром 0,6-1,4 см в зависимости от объема аппарата. На верхний край аппарата надевается синтетический или металлический обруч со сливным рожком. Вода поступает в аппарат через шланг, надеваемый на трубку в нижней ее части. Ток воды поддерживает икринки во взвешенном состоянии на протяжении всего периода инкубации. Сброс воды из аппарата происходит через сливной рожок, перед которым установлена решетка, предохраняющая от выноса из аппарата икринок и выклюнувшихся личинок. Расход воды в стандартном аппарате — 3-4 л/мин. Обычно аппараты Вейса размещаются в стойке до 20 штук. Следует строго следить за вертикальной установкой аппаратов. Любое отклонение от вертикали изменяет направление струи водотока в аппарате, следовательно, нарушает равномерное перемешивание икры и способствует созданию заморных явлений. Подача воды в аппараты независимая, ее сброс осуществляется в общий водосбросной лоток, а из него — в канализационную сеть.
Для размещения икры аппарат Вейса наполовину заполняют водой. Затем при очень слабом ее токе по стенке осторожно вливают в аппарат подготовленную к инкубации икру. Норма загрузки аппарата икрой сигов — до 300 тыс. штук. Это примерно 2/3 объема стандартного аппарата. После заполнения аппарата икрой регулируют его проточность. Расход воды в аппарате по мере развития эмбрионов увеличивается от 2.2 до 4.0 л/мин. Во время включения подачи воды в аппарат необходимо тщательно следить за равномерным перемешиванием икры. В случае неравномерности необходимо отрегулировать вертикальное положение аппарата. Нельзя допускать «кипения» икры, могут быть повреждены ее оболочки с соответствующими негативными последствиями.
Среди других модификаций аппаратов с восходящим током воды пользуются популярностью для инкубации икры сиговых и карповых рыб аппараты Казанского и аппараты Чеза.
Аппарат Казанского является модификацией аппарата Вейса. Его отличительная особенность — установка специальной водоструйной головки для рассеивания потока воды. Головка имеет одно центральное отверстие (d = 5 мм) и шесть боковых (d = 3 мм каждое), направляющих потоки воды под углом 15°. Это приспособление улучшает омываемость инкубируемой икры. Рабочая емкость — до 300 тыс. икринок сиговых, расход воды — 3-4 л/мин.
Аппарат Чеза представляет собой бокаловидную емкость со сливным носиком в верхней части. Вода подается через трубку сверху и рассеивается в аппарате округленным дном. Создаваемый вертикальный поток поддерживает инкубируемую икру во взвешенном состоянии и постоянном движении. Мощность стандартного аппарата — до 300 тыс. икринок сига при расходе воды 3-4 л/мин.
Икра сиговых очень чувствительна к яркому освещению (фотофильна). В то же время не рекомендуется полностью затемнять инкубационные цеха, и особенно инкубационные аппараты. Полное затемнение инкубационных цехов нередко приводит к значительной гибели эмбрионов или выклеву нежизнеспособных личинок. Хорошие результаты получены при инкубации икры сиговых при рассеянном (сумеречном) освещении. Это биологически оправданно, поскольку в природных условиях икра рассеивается по поверхности грунта на нерестилище и попадает под укрытия небольших предметов (мелкой гальки, щебня и др.), в небольшие расщелины и углубления, которые защищают ее от яркого освещения. В то же время слабое освещение сохраняется. Темнота же угнетает процессы метаболизма. Это доказано нашими опытами. В темноте интенсивность потребления кислорода у эмбрионов обыкновенного сига сокращалась до 70 % по сравнению с сумеречными условиями освещения.
Важное значение для обеспечения благоприятных условий развития эмбрионов сиговых имеют нормы загрузки инкубационных аппаратов и объемы их водоснабжения.
На рыбоводных заводах икра сигов обычно инкубируется при температуре от 0.1 до 1.0 °С. При этой температуре эмбриогенез у разных видов сигов продолжается от 210 до 100 суток. Чем выше температура инкубации икры, тем короче эмбриональный период. Если инкубацию икры сигов провести при температуре 1-2 °С, то продолжительность эмбриогенеза сократится на 1/3 часть.
Однако к сокращению продолжительности эмбрионального периода путем повышения температуры воды следует относиться с очень большой осторожностью. Существует зона оптимальных температур, диапазон которых колеблется в пределах от 1.0 до 7.0 °С в зависимости от вида рыб. Не рекомендуется инкубировать икру сигов вблизи верхней температурной границы экологического диапазона (7 °С). Постепенно увеличивать температуру воды до 5-6 °С целесообразно за 3-6 дней до выклева личинок. Это будет способствовать более массовому выклеву личинок.
Наряду с температурой необходимым условием при инкубации икры сигов является сохранение постоянного тока воды с высоким содержанием растворенного в ней кислорода (> 8.5 мг/л). Критическая концентрация кислорода для сигов во время эмбрионального развития равна 7 мг/л. Целесообразно во время дробления яйцеклетки сохранять ток воды в пределах 2.2-2А л/мин, на этапе подвижного эмбриона — 2.6-2.8 л/мин. Перед выклевом личинок ток воды следует увеличить до 4.0 л/мин.
Во время инкубации икры сигов необходимо следить за ее общим состоянием. При появлении погибших икринок рекомендуется их своевременно удалять, чтобы не способствовать развитию сапролегнии. Удалить погибшую икру сигов из аппаратов Вейса не представляет никакой трудности, так как погибшие икринки всплывают и концентрируются над слоем живых развивающихся эмбрионов. По мере накопления погибшие икринки удаляются при помощи сифона или увеличением тока воды через носик обруча аппарата.
Появление тонких нитей сапролегнии показывает на начало этого неприятного заболевания. Необходимо срочно провести профилактическую обработку икры одним из растворов: малахитовым зеленым с уровнем разведения 1/200000 и длительностью обработки 50 минут или раствором фиолетового «К» с концентрацией 5 мг/л и длительностью обработки 25 минут. Для профилактической обработки икры рекомендуется также использовать препарат йодоформ (100 мг/л) или перекись водорода (500-1000 мг/л) при длительности экспозиции 10-15 минут.
Проводя любые манипуляции с икрой, рыбовод должен хорошо знать динамику взаимосвязей эмбрионов на разных этапах развития с условиями окружающей среды. Эта динамика проявляется в изменении чувствительности развивающихся эмбрионов к различным факторам внешней среды. Известно, что в процессе эмбриогенеза существуют так называемые «критические периоды», когда икра очень чувствительна к внешним воздействиям. У сигов высокая чувствительность обнаружена перед и во время гаструляции, а также во время дифференцировки осевых органов. В это время категорически запрещается проводить любые манипуляции с икрой, возможна ее значительная гибель. Например, увеличение тока воды на 10 минут до слабого «кипения» икры во время гаструляции в наших опытах приводило к гибели большого числа эмбрионов (до 78 %).
При появлении в глазах пигмента (стадия «глазка») чувствительность икры к внешним воздействиям снижается и в это время можно проводить профилактические мероприятия, а также обрабатывать икру, переносить, перевозить и т. д. Если икра инкубируется при средней температуре 0,2 °С, стадия глазка у чудского сига наступает на 54-67-й день инкубации, у сига-лудоги — на 60-71-й день, у обыкновенного сига — на 60-68-й день инкубации.
При завершении формирования эмбрионов происходит их освобождение от оболочек икры, начинается выклев личинок. Обычно выклев личинок продолжается несколько дней. В первые 1-2 дня личинки выклевываются единично. Затем скорость выклева увеличивается (этому должно способствовать увеличение температуры воды до 5.0-6.0 °С). Через 5-6 дней выклев личинок прекращается. Выклевывающиеся личинки через носик верхнего обруча инкубационного аппарата с помощью соответствующего шланга размещаются в личиночные ванны или другие рыбоводные емкости для дальнейшего выращивания.
Эмбриональный период развития организма рыбы заканчивается и начинается новый, личиночный, период.
Оценить общее состояние инкубируемой икры возможно по величинам ее оплодотворяемости и последующей выживаемости.
Обычно величину оплодотворяемости определяют на стадии дробления зародышевого диска, когда под бинокуляром достаточно четко видны 2 или 4 бластомера. Для этого отобранные пробы икры (по 30-50 шт.) фиксируют 10 % уксусной кислотой с добавлением 10 г поваренной соли на 1 л раствора или смесью из спирта и ледяной уксусной кислоты в соотношении 3:1. В любой из этих жидкостей оболочки икринок становятся прозрачными, а зародышевый диск отчетливо просматривается под бинокуляром. В каждой пробе определяют количество оплодотворенной (процесс дробления продолжается) и неоплодотворенной (процесс дробления нарушен) икры. Принимая общее количество икры за 100 %, рассчитывается процент ее оплодотворяемости в каждой пробе. Затем вычисляется средний процент оплодотворяемости икры в исследуемой партии по трем пробам. Например, в первой пробе из 50 икринок оказались неоплодотворенными 2 икринки. Процент оплодотворяемости равен 4.0 %. Во второй пробе из 47 икринок 2 также оказались неоплодотворенными. Процент оплодотворяемости равен 4.2 %. В третьей пробе из 45 икринок оказалась неоплодотворенной одна икринка. Доля оплодотворения — 2.2 %. В данной партии икры процент оплодотворяемости равен 4.0 + 4.2 + 2.2 = 10.4: 3 = 3.5 %. Это вполне удовлетворительный результат.
Выживаемость эмбрионов определяют по величинам общего количества инкубируемой и погибшей икры. Погибшая икра включает икринки, отмершие во время ее инкубации, и икринки, оставшиеся после выклева личинок. Например, на инкубацию заложено 300 тыс. икринок сига. За период инкубации погибло 60 тыс. икринок, и 3150 икринок осталось после выклева личинок. Общее количество погибшей икры — 63 150 особей. Выживаемость равна 79.9 %. Согласно нормативам, выживаемость эмбрионов сиговых более 75% признается хорошим результатом инкубации икры. Более точные результаты дает определение процента выживаемости эмбрионов по величине заложенной на инкубацию икры и количества выклюнувшихся личинок. Так, если на инкубацию заложено 300 тыс. икринок, а выклюнулось 225 тыс. личинок, то процент выживаемости эмбрионов будет равен 76 %. При расчете названными способами возможны незначительные расхождения в показателях выживаемости эмбрионов. Обычно они связаны с возможностями учета погибшей икры во время инкубации.
Специалисты и рыбоводы отдают предпочтение второму способу, то есть оценивают состояние инкубируемой икры по количеству выклюнувшихся личинок.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Подготовка икры к инкубации
ПодробностиПросмотров: 1251
Подготовка оплодотворенной икры к инкубации включает в себяее обесклеивание (при необходимости) и профилактическую обра-ботку с целью предупреждения грибковых заболеваний.Неклейкую икру лососевых и некоторых видов сигов (пелядь, ря-пушка, чир и др.) перед размещением в инкубационные аппараты про-мывают проточной водой. Клейкую икру проходных и полупроходныхсигов (омуль, муксун, пыжьян и др.), а также осетровых и карповыхпредварительно обесклеивают.Обесклеивание проводят вручную, перемешивая икру с суспен-зией из взвешенных частиц или путем барботажа смеси пузырькамивоздуха в аппаратах Вейса и других специальных аппаратах для обес-клеивания икры (рис. 13). В аппаратах клейкое вещество изолируетсяза счет прилипания к нему взвешенных частиц.
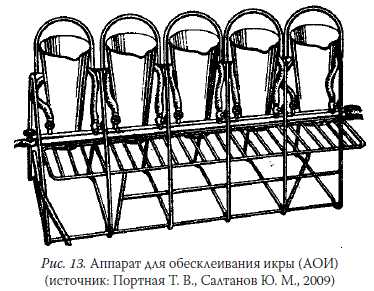 Рис. 13. Аппарат для обесклеивания икры (АОИ)(источник: Портная Т. В., Салтанов Ю. М., 2009)В качестве обесклеивающего вещества используют мел, тальк,обезжиренное молоко, ил, картофельный крахмал или растительноемасло. Каждое из них имеет свои преимущества и недостатки. Мели тальк утяжеляют обесклеенную икру и делают непрозрачными ееоболочки. Первое нежелательно при инкубации икры в аппаратахВейса, а второе затрудняет наблюдение за развитием эмбрионов.Различные сорта молока, крахмала и растительного масла обладаютразными обесклеивающими качествами, к тому же это дорогие пи-щевые продукты. Процедура приготовления ила для обесклеиванияикры весьма трудоемка: она предусматривает заготовку, промывкуи стерилизацию.Для обесклеивания икры осетровых традиционно используюттальк, мел или минеральный ил. Суспензию из талька (мела) изготав-ливают в следующей пропорции: 15–200 г талька (мела), 15−20 г пова-ренной соли и 10 л воды. На 1 кг икры требуется 0,5 л густой взвесиила и 4 л воды. При обесклеивании икра все время должна находитьсяв движении. Процесс продолжают до тех пор, пока икринки не пере-станут склеиваться друг с другом (обычно 40−60 минут). После этогоикру промывают чистой водой.В 1999 году С. Б. Подушка со специалистами осетроводами доказа-ли, что голубая глина является эффективным и надежным средствомдля обесклеивания икры стерляди и сибирского осетра. Для полу-чения однородной суспензии две-три горсти глины вносят в 8−10 лводы и тщательно перемешивают. Так как частички глины оседаютдовольно быстро, то суспензию повторно взбалтывают и после этогочерез сито приливают к икре. Расходуется глина экономно: стандарт-ной упаковки сухой глины (3 кг) достаточно для обесклеивания 10 кгикры. Процедура обесклеивания глиной длится 35−45 минут. Приэтом оболочки икринок остаются прозрачными.В современной литературе по осетроводству, кроме вышепере-численных препаратов, для обесклеивания икры осетровых такжерекомендуется использование танина, применение которого требуетточности дозировки и времени обработки (табл. 8), поскольку пре-вышение этих параметров может вызвать гибель икры.Таблица 8. Рекомендации по обесклеиванию икры осетровых(Чебанов М. С., 2013)
Рис. 13. Аппарат для обесклеивания икры (АОИ)(источник: Портная Т. В., Салтанов Ю. М., 2009)В качестве обесклеивающего вещества используют мел, тальк,обезжиренное молоко, ил, картофельный крахмал или растительноемасло. Каждое из них имеет свои преимущества и недостатки. Мели тальк утяжеляют обесклеенную икру и делают непрозрачными ееоболочки. Первое нежелательно при инкубации икры в аппаратахВейса, а второе затрудняет наблюдение за развитием эмбрионов.Различные сорта молока, крахмала и растительного масла обладаютразными обесклеивающими качествами, к тому же это дорогие пи-щевые продукты. Процедура приготовления ила для обесклеиванияикры весьма трудоемка: она предусматривает заготовку, промывкуи стерилизацию.Для обесклеивания икры осетровых традиционно используюттальк, мел или минеральный ил. Суспензию из талька (мела) изготав-ливают в следующей пропорции: 15–200 г талька (мела), 15−20 г пова-ренной соли и 10 л воды. На 1 кг икры требуется 0,5 л густой взвесиила и 4 л воды. При обесклеивании икра все время должна находитьсяв движении. Процесс продолжают до тех пор, пока икринки не пере-станут склеиваться друг с другом (обычно 40−60 минут). После этогоикру промывают чистой водой.В 1999 году С. Б. Подушка со специалистами осетроводами доказа-ли, что голубая глина является эффективным и надежным средствомдля обесклеивания икры стерляди и сибирского осетра. Для полу-чения однородной суспензии две-три горсти глины вносят в 8−10 лводы и тщательно перемешивают. Так как частички глины оседаютдовольно быстро, то суспензию повторно взбалтывают и после этогочерез сито приливают к икре. Расходуется глина экономно: стандарт-ной упаковки сухой глины (3 кг) достаточно для обесклеивания 10 кгикры. Процедура обесклеивания глиной длится 35−45 минут. Приэтом оболочки икринок остаются прозрачными.В современной литературе по осетроводству, кроме вышепере-численных препаратов, для обесклеивания икры осетровых такжерекомендуется использование танина, применение которого требуетточности дозировки и времени обработки (табл. 8), поскольку пре-вышение этих параметров может вызвать гибель икры.Таблица 8. Рекомендации по обесклеиванию икры осетровых(Чебанов М. С., 2013)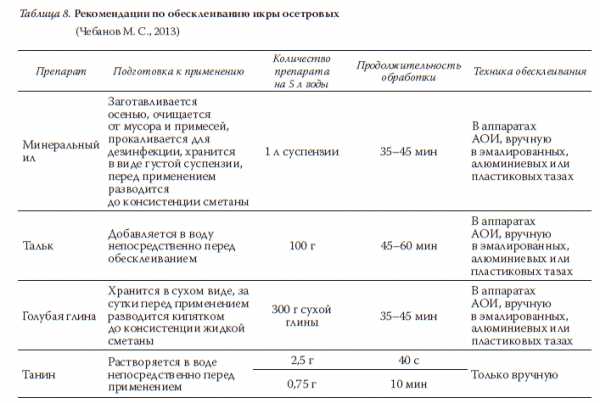 Икру карповых обесклеивают в аппаратах Вейса с применениемсуспензии талька или смеси обезжиренного молока с водой. Талькпредварительно расфасовывают в пакетики по 100 г и добавляютк нему 10−15 г поваренной соли. Содержимое одного пакетика раз-водят в 10 л воды. Для получения обесклеивающего раствора с при-менением молока добавляют воду в соотношении 1 : 8 − 1 : 10 или10−15 г сухого молока растворяют в 1 л воды. Также применяетсяэмульсия молоко − вода (1 : 6) с добавлением 20 мл глицерина на7−8 л раствора.Для обесклеивания икры в аппарат Вейса наливают обесклеива-ющий раствор, подают сжатый воздух и загружают икру (на 8 л рас-твора 0,8–1 кг икры). Воздух подают с таким расчетом, чтобы икраинтенсивно перемешивалась. По мере набухания икры добавляютобесклеивающий препарат. Через 35−40 минут пробу икры прове-ряют на клейкость, поместив в чашку Петри с чистой водой. Еслипо истечении 5 минут икринки не приклеились к стеклу, обесклеи-вание считается законченным. В противном случае обесклеиваниепродолжают.Для обесклеивания икры карповых также применяется эмульсиярастительных масел (0,4−0,7 %) или белых минеральных (1,0 %). Принеобходимости добавляют еще 0,15 % нейтрального мыла в качествеэмульгатора.Обесклеивание икры сиговых обычно проводят вручную. Для этойцели в приготовленную обесклеивающую суспензию (талька или мо-лока) равномерно вливают икру (1,0–1,5 кг икры на 8−10 л суспен-зии). При этом икру и суспензию тщательно перемешивают в тече-ние 20–30 минут. При завершении перемешивания икру промываютв проточной воде или часто (не менее 2–3 раз) меняя воду в емкостис икрой. Тщательно отмытую от суспензии икру с целью предупреж-дения грибковых заболеваний подвергают профилактической обра-ботке в дезинфицирующем растворе. Для этого используют растворхлорамина в концентрации 1 : 30000 (экспозиция 20 минут) или пе-рекись водорода в дозировке 500–1000 мг/л (экспозиция 15 минут).Затем икру вновь тщательно промывают водой и закладывают на ин-кубацию в специальные аппараты, которые предварительно дезинфи-цируют свежим раствором хлорной извести.
Икру карповых обесклеивают в аппаратах Вейса с применениемсуспензии талька или смеси обезжиренного молока с водой. Талькпредварительно расфасовывают в пакетики по 100 г и добавляютк нему 10−15 г поваренной соли. Содержимое одного пакетика раз-водят в 10 л воды. Для получения обесклеивающего раствора с при-менением молока добавляют воду в соотношении 1 : 8 − 1 : 10 или10−15 г сухого молока растворяют в 1 л воды. Также применяетсяэмульсия молоко − вода (1 : 6) с добавлением 20 мл глицерина на7−8 л раствора.Для обесклеивания икры в аппарат Вейса наливают обесклеива-ющий раствор, подают сжатый воздух и загружают икру (на 8 л рас-твора 0,8–1 кг икры). Воздух подают с таким расчетом, чтобы икраинтенсивно перемешивалась. По мере набухания икры добавляютобесклеивающий препарат. Через 35−40 минут пробу икры прове-ряют на клейкость, поместив в чашку Петри с чистой водой. Еслипо истечении 5 минут икринки не приклеились к стеклу, обесклеи-вание считается законченным. В противном случае обесклеиваниепродолжают.Для обесклеивания икры карповых также применяется эмульсиярастительных масел (0,4−0,7 %) или белых минеральных (1,0 %). Принеобходимости добавляют еще 0,15 % нейтрального мыла в качествеэмульгатора.Обесклеивание икры сиговых обычно проводят вручную. Для этойцели в приготовленную обесклеивающую суспензию (талька или мо-лока) равномерно вливают икру (1,0–1,5 кг икры на 8−10 л суспен-зии). При этом икру и суспензию тщательно перемешивают в тече-ние 20–30 минут. При завершении перемешивания икру промываютв проточной воде или часто (не менее 2–3 раз) меняя воду в емкостис икрой. Тщательно отмытую от суспензии икру с целью предупреж-дения грибковых заболеваний подвергают профилактической обра-ботке в дезинфицирующем растворе. Для этого используют растворхлорамина в концентрации 1 : 30000 (экспозиция 20 минут) или пе-рекись водорода в дозировке 500–1000 мг/л (экспозиция 15 минут).Затем икру вновь тщательно промывают водой и закладывают на ин-кубацию в специальные аппараты, которые предварительно дезинфи-цируют свежим раствором хлорной извести.
Смотрите также
Выращивание рыбы
Статьи по аквакультуре
arktikfish.com
Получение, осеменение и инкубация икры.
ПодробностиПросмотров: 1057
Получение, осеменение и инкубация икры.
(Источник: Морская аквакультура. П. А. Моисеев, А.Ф. Карпевич, О. Д. Романычева и др. - М.: Агропромиздат, 1985)
Перед получением икры самок забивают. Чтобы кровь не попала в таз с икрой, так как это может ухудшить качество икры, самку обескровливают путем перерезания хвостовой или жаберной артерии. Места разреза обмывают водой, забинтовывают, чтобы кровь не попала на икру самку поднимают за голову через перекладину или блок и закрепляют в вертикальном положении. Под брюшко подставляют таз, часть икры свободно стекает в таз, затем разрезают брюшко вверх от генитального отверстия на 20- 30 см и вынимают основную порцию икры, а после этого увеличивают разрез почти до головы и извлекают оставшуюся икру. От каждой самки икру отбирают в отдельную посуду.Полученную икру взвешивают, затем берут 2-3 навески по 5-10 г. В каждой просчитывают количество икринок определяют их количество в 1 г и пересчитывают на всю массу икры. Количество икры можно определять и объемным методом.Перед осеменением икры сперму от 3-4 самцов смешивают, доводят до объема 10 см3 на 1 кг икры Осеменяют икру осетровых рыб полусухим методом Для этого сперму в момент осеменения разбавляют водой в соотношении 1:200 и выливают в таз с икрой. В течение 3-5 мин тщательно перемешивают икру со спермой, после чего икру 3-4 раза быстро промывают водой для удаления слизи и спермы.Отмытую икру, если ее инкубация проводится в приклеенном состоянии, осторожно раскладывают по лоткам инкубационного аппарата И. А. Садова и Е. М. Коханской При инкубации икры, во взвешенном состоянии ее необходимо предварительно обесклеить. Для этого к 1 кг икры приливают 0,5 л густой взвеси ила и 4 л воды и перемешивают. При этом икра должна находиться все время в движении. Обесклеивание продолжают до тех пор, пока икринки не перестанут склеиваться друг с другом. Обесклеивание икры продолжается 40-60 мин. Кроме ила для обесклеивания икры можно применять суспензию мела, танин, тальк. Отмывку икры производят в аппаратах конструкции Р. К. Латыпова, Э. В. Орлова, в аппаратах АОИ и др.После обесклеивания икру в течение 30-40 мин нужно поместить в инкубационные аппараты, в которых инкубация ведется во взвешенном состоянии Для этого используют -аппараты П. С. Ющенко, А. Н. Щеколкина, В. М. Федченко, Л. Т. Горбачевой, Б. Н. Казанского и др. В этих аппаратах создаются вихревые потоки воды, которые периодически поднимают икру в толщу воды и способствуют лучшему омыванию ее водой.В период инкубации икры тщательно следят за работой аппаратов, контролируют количество кислорода в воде, определяют скорость эмбрионального развития, отбирают погибшую и пораженную сапролегнией икру, применяют меры борьбы и профилактики против развития сапролегнии. Чтобы икра нормально развивалась, необходимо постоянно контролировать расход воды в аппаратах.В случае появления сапролегнии икру обрабатывают малахитовым зеленым. В этот период усиливают контроль над содержанием кислорода в воде. При повышении рН необходимо увеличить расход воды и создать большую проточность. Оптимальный режим температуры воды при инкубации икрьг белуги 8-14╟С, осетра 12-20 и севрюги 17-23╟С.
Норма расхода воды в инкубационных аппаратах на различных стадиях развития икры, л/мин на 1 кг икры| Дробление | 2,3 |
| Гаструляция | 2,3-3 |
| От конца гаструляции до пульсации сердца | 3-4,5 |
| От пульсации сердца до стадии подвижного эмбриона | 4,6-5 |
| Вьклев | 5,8-6,2 |
Рис. 1. Развитие икры осетровых:
а -оплодотворенное яйцо (1) и активированное партеногенвтически дробящееся яйцо (2) из одной пробы икры севрюги; б-нормально развивающееся моноспермное яйцо (3) и полисп╓рмное яйцо (4)
Для определения результатов осеменения икры на стадии четырех бластомеров проводят подсчет процента оплодотворения. На этой стадии можно отличить неоплодотвор╓нную икру (активированную и неактивированную), полиспермную и нормально развивающуюся.Нормальная икра на этой стадии имеет четыре одинаковых бластомера и ч╓ткий пигментный рисунок. Неоподотвор╓нная икра сохраняет свою первоначальную форму, икринки не поворачиваются анимальным полюсом вверх, оболочка их слабо клеится. Среди неоплодотворенных икринок (яиц) обычно присутствуют и партеногенетически развивающиеся активированные яйца, т. е. яйца, приступившие к развитию, хотя и не были оплодотворены (рис. 1).Активированные яйца в начальный период развития ведут себя как оплодотворенные, они поворачиваются анимальным полюсом вверх, у них образуется перивителлиновое пространство, изменяется пигментный рисунок. Икра хорошо клеится и набухает. Однако дробление активированных яиц протекает неправильно, затем приостанавливается совсем, и яйца постепенно отмирают.Полиспермная икра -это -оплодотворенная икра, в которую проникли и принимают участие в развитии несколько, сперматозоидов, так как у икры осетровых имеется не одно, а несколько микропиле. Процесс дробления идет ускоренно, и при первом делении сразу возникает 3-4 и больше бластомеров, на стадии четырех бластомеров в полиспермной икре уже бывает шесть и более бластомеров. А. С, Гинзбург отмечает, что полиспермные яйца развиваются атипично и погибают чаще всего еще до завершения инкубации, а выклюнувшие из такой икры эмбрионы нежизнеспособны.Неоплодотворенная (активированная и неактивированная), а также полиспермная икра в процессе инкубации отмирает, поэтому процент оплодотворения исчисляется от количества нормально развивающейся икры.В период инкубации количество погибшей икры определяют также в конце стадии гаструляции и начале нейруляции, в период закладки сердца и перед началом вылупления. Для этого из каждого инкубационного аппарата берут 300-500 икринок и внимательно просматривают.Среди вылупившихся эмбрионов .бывают и уродливые, поэтому на основании пробы, содержащей 100-200 шт. эмбрионов, определяют процент нормальных и уродливых особей, отмечают характер уродств: искривление позвоночника, недоразвитый передний отдел и др.Вылупившиеся из икринки свободные эмбрионы (предличинки) длиной 10-11 мм имеют большой желточный мешок, за счет запасов которого они живут до перехода на внешнее питание.
biblio.arktikfish.com
Осеменение и инкубация икры
В рыбоводстве применяют различные способы искусственного осеменения икры. Для осеменения икры осетровых рыб лучшим является полусухой способ. Осеменение производят в течении 10-20 минут после извлечения икры из самки. Смесью спермы от 3 – до 5 самцов. Тогда оплодотворяемость икры и выживаемость эмбрионов больше, т.к. у икринок разная избирательность к сперме. При отборе икры важно, что бы на нее не попадал прямой солнечный свет. Смешивание также надо производить при рассеянном свете.
Осеменение.
На 1 кг икры используют 10 куб. сантиметров спермы. Разведенной двумя литрами воды. Разведенную сперму тщательно перемешивают с икрой в течении 3-5 минут. После чего оплодотворенную икру 3 раза быстро промывают для удаления слизи и спермы. Перемешивание икры необходимо проводить только гусиным пером. Важной что бы температура воды при проведении всех технологических манипуляций с икрой была одинаковой. Качество оплодотворения икры определяют в лабораторных условиях. Что бы определить процент оплодотворения берут пробу из общего количества икры заложенного на инкубацию. Пробы икры у осетровых составляет 300 – 350 икринок. У карповых 300 – 400 икринок. Процент оплодотворения икры определяют во время второго деления на стадии дробления. Просматривают под бинокуляром. Процент оплодотворения осетровых видов рыб составляет:
Ошибки:
перемешивание икры производят рукой, а не гусиным пером, что приводит к травматизации икры.
Обесклеивание
Аппарат Вейса загружают оплодотворенной икрой, предварительно в аппарат наливают 2,5 – 3 литра обесклеивающего раствора. Для осетровых из расчета 2 литра молока на 8 литров воды. Затем подают через вентиль с сжатым воздухом с таким расчетом, что бы икра интенсивно перемешивалась но не выплескивалась. Через 40 – 50 минут икру проверяют на клейкость. В чашку Петри с водой помещают икринки. Если в течении 5 минут икринки не приклеились к стеклу, то обесклеиваие можно считать законченным. После завершения обесклеивания – подачу воздуха прекращают и подают воду. Расход воды в аппараты Вейса во время инкубации икры осетровых рыб– 3 – 4 минуты.
Рыбоводы широко используют другой способ обесклеивания – химический, с использованием раствора танина. Из расчета 0,5 г на 1 литр воды. Обесклеивание проводят в тазике или миске. На 1 литр икры необходимо 2 литра раствора танина. Икру мешают пером при строгом соблюдении времени – только 40 секунд. Затем двукратно промывают водой и помещают в инкубационные аппараты.
Инкубация
Инкубация икры осетровых длится несколько суток и зависит от температуры воды. Так при температуре воды 12 – 18 градусов Цельсия время инкубации продолжается от 5 до 10 суток. В этот период необходимо ухаживать за икрой: регулировать расход воды в аппаратах, профилактически обрабатывать икру и своевременно удалять погибшие икринки с целью недопущения развития опасного грибкового заболевания - сапролегнии, способной вызвать гибель икры в аппарате до 100 %. При температуре вод 22 градуса Цельсия развитие икры происходит наиболее оптимально и быстрее, чем развитие сапролегнии. Систематическое использование органических красителей позволяет постоянно сдерживать размножение гифов сапролегнии находящихся постоянно в воде, поступающей в цех из водоисточника. Сразу после выклева прелдичинок переносят в заранее подготовленные лотки. Как правило, предличинок не кормят, т.к. они питаются за счет запасов желточного мешка. В лотках в зависимости от температуры воды личинок выдерживают на протяжении 5-10 суток, т.е. до перехода на активное питание. Затем начинают ее подкармливать живыми и искусственными специализированными кормами. По достижении массы 0,2 г. молодь необходимо сортировать и рассаживать – уменьшая плотности посадки. Обеспечивая тем сам ее рациональный прирост и нормальное использование кормов.
studfiles.net